题目内容
17.一定条件下,向2L密闭容器中加入2molN2和10molH2,发生反应N2(g)+3H2(g)?2NH3(g).2min时测得剩余N2为1mol,此时表示的化学反应速率正确的是( )| A. | v(N2)=0.25mol•L-1•min-1 | B. | v(H2)=0.5mol•L-1•min-1 | ||
| C. | v(NH3)=1mol•L-1•min-1 | D. | v(NH3)=0.25mol•L-1•min-1 |
分析 根据v=$\frac{△c}{△t}$计算v(N2),再利用速率之比等于化学计量数之比计算v(H2)、v(NH3).
解答 解:在一定条件下,向2L密闭容器中加入2mol N2和10molH2,发生反应N2(g)+3H2(g)?2NH3(g),2min末时,测得剩余氮气为1mol,故2min内,以 N2表示的反应速率v(N2)=$\frac{\frac{2mol-1mol}{2L}}{2min}$=0.25 mol/(L•min),
根据速率之比等于化学计量数之比可知:
v(H2)=3v(N2)=3×0.25 mol/(L•min)=0.75 mol/(L•min),
v(NH3)=2v(N2)=2×0.25 mol/(L•min)=0.5mol/(L•min),
故选A.
点评 本题考查化学反应速率的计算,比较基础,常用计算方法有定义法与化学计量数法,根据情况选择合适的计算方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.在钠与水反应的实验操作中,符合化学实验安全规则的是( )
| A. | 不经切割,直接用大块的钠做实验 | B. | 用手小心抓住钠块投入烧杯中 | ||
| C. | 在烧杯口盖上玻片后再观察现象 | D. | 将剩余的钠块放入废液缸 |
8.下列实验事实不能用同一原理解释的是( )
| A. | SO2、Cl2都能使品红溶液褪色 | |
| B. | NH4Cl晶体、固体碘受热时都能气化 | |
| C. | 福尔马林、葡萄糖与新制Cu(OH)2共热时都能产生红色沉淀 | |
| D. | 乙烯通入酸性高锰酸钾溶液和溴水都能使其褪色 |
5.下列属于氧化物的是( )
| A. | 冰水混合物 | B. | 氧气 | C. | 氯酸钾 | D. | 乙醇 |
12.已知1g H2在O2中燃烧生成液态水放出142.9kJ的热量,则下列热化学方程式正确的是( )
| A. | 2H2(g)+O2(g)=2H2O(l)△H=-142.9 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)=2H2O(l)△H=+571.6 kJ•mol-1 | |
| C. | H2(g)+$\frac{1}{2}$O2(g)=2H2O(g)△H=-285.8 kJ•mol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)=2H2O(l)△H=-285.8 kJ•mol-1 |
9.一定条件下,H2O2在水溶液中发生分解反应:2H2O2$\frac{\underline{\;一定条件\;}}{\;}$2H2O+O2↑
反应过程中,测得不同时间H2O2的物质的量浓度如表:
(1)H2O2的分解反应是氧化还原反应(填“是”或“不是”).要加快该反应的速率,可采取的方法有升高温度、使用催化剂、增加H2O2的浓度.
(2)该分解反应0─20min的平均反应速率v(H2O2)为0.02mol•L-1 min-1.
(3)如果反应所用的H2O2溶液为100mL,则共产生O2Cg.
A.0.08 B.0.16 C.1.2D.2.4.
反应过程中,测得不同时间H2O2的物质的量浓度如表:
| t/min | 0 | 20 | 40 | 60 | 80 |
| c(H2O2)/mol•L-1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
(2)该分解反应0─20min的平均反应速率v(H2O2)为0.02mol•L-1 min-1.
(3)如果反应所用的H2O2溶液为100mL,则共产生O2Cg.
A.0.08 B.0.16 C.1.2D.2.4.
6.二氧化硫是引起酸雨的一种物质,二氧化硫属于( )
| A. | 电解质 | B. | 酸性氧化物 | C. | 含氧酸 | D. | 混合物 |
7.有机物A是合成二氢荆芥内酯的重要原料,其结构简式为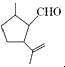 ,下列检验A中官能团的试剂和顺序正确的是( )
,下列检验A中官能团的试剂和顺序正确的是( )
 ,下列检验A中官能团的试剂和顺序正确的是( )
,下列检验A中官能团的试剂和顺序正确的是( )| A. | 先加酸性高锰酸钾溶液,后加银氨溶液,微热 | |
| B. | 先加溴水,后加酸性高锰酸钾溶液 | |
| C. | 先加新制氢氧化铜,微热,再加入溴水 | |
| D. | 先加入银氨溶液,微热,酸化后再加溴水 |
