题目内容
19.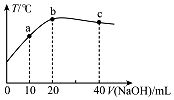 在一隔热系统中,向20.00mL 0.01000mol•L-1的醋酸溶液中逐滴加入0.01000mol.L-1的NaOH溶液,测得混合溶液的温度变化如图.下列相关说法正确的是( )
在一隔热系统中,向20.00mL 0.01000mol•L-1的醋酸溶液中逐滴加入0.01000mol.L-1的NaOH溶液,测得混合溶液的温度变化如图.下列相关说法正确的是( )| A. | 若a点溶液呈酸性,则a点有:c(CH3COO-)>c(Na+)>c(CH3COOH) | |
| B. | 从b到c:$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$逐渐增大 | |
| C. | 水的电离程度:b点<c点 | |
| D. | b点有0.01000mol•L-1+c(H+)=c(Na+)-c(CH3COOH)+c(OH-) |
分析 A.a点溶液中溶质为等浓度的醋酸和醋酸钠;
B.b点到c点氢氧化钠过量,氢氧化钠抑制醋酸根离子的水解,醋酸的浓度减小;
C.b点溶液中溶质为醋酸钠,c点溶液中溶质为醋酸钠和氢氧化钠,醋酸钠促进水的电离,氢氧化钠抑制水的电离;
D.b点溶液中溶质为醋酸钠,根据电荷守恒和物料守恒分析.
解答 解:A.a点溶液中溶质为等浓度的醋酸和醋酸钠,溶液显酸性,醋酸的电离程度大于醋酸钠的水解程度,所以a点有:c(CH3COO-)>c(Na+)>c(CH3COOH),故A正确;
B.b点醋酸与氢氧化钠恰好反应生成醋酸钠,从b点到c点氢氧化钠逐渐过量,氢氧化钠抑制醋酸根离子的水解,醋酸的浓度减小,所以:$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$逐渐减小,故B错误;
C.b点醋酸与氢氧化钠恰好反应生成醋酸钠,醋酸钠水解促进水的电离,c点溶液中溶质为醋酸钠和氢氧化钠,氢氧化钠抑制水的电离,所以水的电离程度:b点>c点,故C错误;
D.b点醋酸与氢氧化钠恰好反应生成醋酸钠,醋酸钠的浓度为0.005000mol•L-1,溶液中电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒为:c(Na+)=c(CH3COOH)+c(CH3COO-),则0.005000mol•L-1+c(H+)=c(Na+)-c(CH3COOH)+c(OH-),故D错误.
故选A.
点评 本题考查了弱电解质的电离、盐的水解,题目难度中等,侧重于考查学生的分析能力和计算能力,注意把握溶液中的电荷守恒和物料守恒.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
9.下列对烃的分类不正确的是( )
| A. | CH4、CH2═CH2、CH2═CHCH═CH2均属于饱和链烃 | |
| B. | CH3CH2CH3、CH3CH═CH2、CH3CH═CHCH2CH═CH3均属于脂肪链烃 | |
| C. | CH3CH3、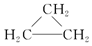 、C18H38均属于饱和烃 、C18H38均属于饱和烃 | |
| D. | 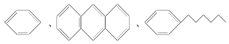 均属于芳香烃 均属于芳香烃 |
10.向含有Na+、NH4+、Al3+、Fe2+的溶液中,加入足量的NaOH溶液以后,微热并拌;然后加入足量的盐酸,溶液中离子的数目保持不变的是( )
| A. | Fe2+ | B. | NH4+ | C. | Al3+ | D. | Na+ |
7.将一小快钠下列溶液时,既能产生气体最终又有白色沉淀的是( )
| A. | 氯化亚铁溶液 | B. | 氢氧化钠稀溶液 | C. | 硫酸铜溶液 | D. | 氯化镁溶液 |
14.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1L0.1mol•L-1的NaHSO4溶液中HSO4-总数为0.1NA | |
| B. | 16g16O2和18g18O2中含有的质子数均为8NA | |
| C. | 1molFe与足量的稀硝酸反应,转移电子数为2NA | |
| D. | 标准状况下,2.24LCl2溶于水所得溶液中含有的氯离子数为0.1NA |
11.在恒温2L密闭容器中通入气体X并发生反应:2X(g)═Y(g)△H<0,X的物质的量n(x)随时间t变化的曲线如图所示(图中的两曲线分别代表有无催化剂的情形),下列叙述正确的是( )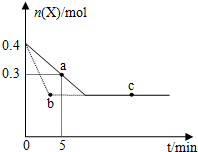

| A. | 虚线表示使用催化剂的情形 | |
| B. | b、c两点表明反应在相应条件下达到了最大限度 | |
| C. | 反应进行到a点时放出的热量大于反应进行到b点时放出的热量 | |
| D. | 反应从开始到a点的平均反应速率可表示为v(Y)=0.01mol/(L•min) |
8.下列有关颜色变化错误的是( )
| A. | 在4mL0.1mol/L的K2Cr2O7溶液中滴加数滴1mol/LNaOH溶液,溶液颜色从橙色变成黄色 | |
| B. | 向Na2S2O3溶液中滴入足量稀硫酸,溶液最终为无色 | |
| C. | 向血红色的Fe(SCN)3溶液中加入少量KI固体,溶液颜色变浅 | |
| D. | 用50mL针筒抽取30mL红棕色的NO2气体并封住注射孔,当用力推压活塞,压缩针筒中的气体(此过程中不考虑温度变化),气体颜色逐渐变浅 |
9.下列事实不能用电化学原理解释的是( )
| A. | 镀锌铁片比镀锡铁片更耐腐蚀 | |
| B. | 远洋海轮的尾部装上一定数量的锌板 | |
| C. | 用锌与硫酸制氢气时,往硫酸中滴少量硫酸铜 | |
| D. | 常温条件下,在空气中铝不易被腐蚀 |
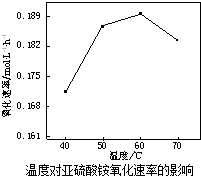 利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下:
利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下:
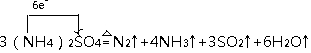 .
.