题目内容
1.下列叙述正确的是( )| A. | 根据核磁共振氢谱不能鉴别1-溴丙烷和2-溴丙烷 | |
| B. | 沸点:CH3CH3>CH3CH2OH;密度: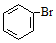 > >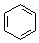 | |
| C. | 苯酚钠溶液中通入少量的CO2离子方程式为:C6H5O-+H2O+CO2→C6H5OH+CO32- | |
| D. | 要检验溴乙烷中的溴元素,向其中加入NaOH溶液共热,冷却后先加硝酸酸化,再加入硝酸银溶液,观察有无浅黄色沉淀生成 |
分析 A.1-溴丙烷和2-溴丙烷中H的种类分别为3、2;
B.含-OH的有机物易形成氢键,沸点高,相对分子质量大的密度大;
C.苯酚钠溶液中通入少量的CO2,反应生成苯酚、碳酸氢钠;
D.卤代烃水解后,在酸性条件下检验卤素离子.
解答 解:A.1-溴丙烷和2-溴丙烷中H的种类分别为3、2,则核磁共振氢谱能鉴别-1溴丙烷和2-溴丙烷,故A错误;
B.含-OH的有机物易形成氢键,沸点高,相对分子质量大的密度大,则沸点:CH3CH3<CH3CH2OH;密度: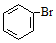 >
> ,故B错误;
,故B错误;
C.苯酚钠溶液中通入少量的CO2,反应生成苯酚、碳酸氢钠,则离子反应为C6H5O-+H2O+CO2→C6H5OH+HCO3-,故C错误;
D.卤代烃水解后,在酸性条件下检验卤素离子,则检验溴乙烷中的溴元素,向其中加入NaOH溶液共热,冷却后先加硝酸酸化,再加入硝酸银溶液,观察有无浅黄色沉淀生成,操作合理,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的结构、官能团、性质为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
11.下列关于有机化台物的说法正确的是( )
| A. | C3H2Cl6有4种同分异构体 | B. | 氯乙烯和聚乙稀均能发生加成反应 | ||
| C. |  的名称为异丁烷 的名称为异丁烷 | D. | C2H4和C4H8一定是同系物 |
12.下列有关水处理方法不正确的是( )
| A. | 用石灰、碳酸钠等碱性物质处理废水中的酸 | |
| B. | 用氯气处理水中的Cu2+、Hg+等重金属离子 | |
| C. | 用可溶性的铝盐和铁盐处理水中的悬浮物 | |
| D. | 用烧碱处理含高浓度NH4+的废水并回收利用氨 |
9.将硫酸铝、硫酸钾和明矾溶液[KAl(SO4)2]等体积等浓度混合.该混合溶液中SO42-浓度为0.4mol/L.取100mL混合液加入0.4mol/L的KOH溶液,若要产生的沉淀量最大,加入该浓度的KOH的体积是( )
| A. | 100mL | B. | 150mL | C. | 200mL | D. | 250mL |
16.1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,此反应的热化学方程式( )
| A. | C+H2O═CO+H2 -131.3KJ | B. | C(s)+H2O(g)═CO(g)+H2(g)-10.94KJ | ||
| C. | C(s)+H2O(g)═CO(g)+H2(g)+131.3KJ | D. | C(s)+H2O(g)═CO(g)+H2(g)-131.3KJ |
6.化学在工业生产方面有着广泛的应用,主要通过技术创新和改进,生产各种化学品.在下列化工生产中,发生的主要反应不涉及化学变化的是( )
| A. | 石油分馏 | B. | 乙烯制聚乙烯 | C. | 工业冶炼铁 | D. | 从海水中提取镁 |
13.下列说法正确的是( )
| A. | 一定条件下 2SO2(g)+O2(g)?2SO3(g)△H<0达到平衡,降温时,v (O2)正比v (O2)逆减小的程度大 | |
| B. | 在 0.1mol•L-1 NaHCO3 溶液中,加入少量 NaOH 固体,Na+、CO32- 的离子浓度均增大 | |
| C. | 增大反应物浓度,可增大活化分子百分数,从而使有效碰撞次数增多 | |
| D. | 电解精炼铜时,若阳极质量减少32g,则阴极转移的电子一定为 1mol |
10.在0℃和101kPa的条件下,将1.40g氮气和1.60g氧气混合,该混合气体的密度是相同条件下氢气密度的( )
| A. | 15倍 | B. | 14倍 | ||
| C. | 14-16倍之间任意倍数 | D. | 16倍 |
15.下列有关有机物的说法正确的是( )
| A. | 分子式为C4H10的二氯取代物的同分异构体有8种 | |
| B. | 相对分子质量相差14或14的整数倍的有机物互为同系物 | |
| C. | 1mol有机物 最多可与5molH2发生加成反应 最多可与5molH2发生加成反应 | |
| D. | 用氯乙烯制聚氯乙烯的原子利用率为100% |