题目内容
10.在0℃和101kPa的条件下,将1.40g氮气和1.60g氧气混合,该混合气体的密度是相同条件下氢气密度的( )| A. | 15倍 | B. | 14倍 | ||
| C. | 14-16倍之间任意倍数 | D. | 16倍 |
分析 利用n=$\frac{m}{M}$计算各气体的物质的量,再利用$\overline{M}$=$\frac{m(总)}{n(总)}$计算混合气体的平均摩尔质量,相同条件下,气体的摩尔质量之比等于密度之比,以此来解答.
解答 解:n(N2)=$\frac{1.40g}{28g/mol}$=0.05mol,n(O2)=$\frac{1.60g}{32g/mol}$=0.05mol,
则混合气体的平均摩尔质量为$\frac{1.40g+1.60g}{0.05mol+0.05mol}$=30g/mol,
又相同条件下,气体的摩尔质量之比等于密度之比,所以该混合气体的密度是相同条件下氢气密度的$\frac{30g/mol}{2g/mol}$=15倍,
故选A.
点评 本题考查阿伏伽德罗定律及其推论,明确相同条件下气体的摩尔质量之比等于密度之比是解答本题的关键,注意平均摩尔质量的计算,题目难度不大.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
1.下列叙述正确的是( )
| A. | 根据核磁共振氢谱不能鉴别1-溴丙烷和2-溴丙烷 | |
| B. | 沸点:CH3CH3>CH3CH2OH;密度: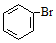 > >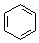 | |
| C. | 苯酚钠溶液中通入少量的CO2离子方程式为:C6H5O-+H2O+CO2→C6H5OH+CO32- | |
| D. | 要检验溴乙烷中的溴元素,向其中加入NaOH溶液共热,冷却后先加硝酸酸化,再加入硝酸银溶液,观察有无浅黄色沉淀生成 |
18.25℃,两种酸的电离平衡常数如下表.
①0.10mol•L-1NaHSO3溶液中离子浓度由大到小的顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
②向NaHCO3溶液中通入少量二氧化硫时反应的离子方程式为SO2+HCO3-=HSO3-+CO2 .
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②向NaHCO3溶液中通入少量二氧化硫时反应的离子方程式为SO2+HCO3-=HSO3-+CO2 .
15.短周期主族元素W、Q、X、Y的原子序数依次增大,W和Q的简单化合物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的,W、X可以形成两种化合物.下列说法不正确的是( )
| A. | W、Q、X三种元素可以组成共价化合物和离子化合物 | |
| B. | Q的简单氢化物的热稳定性比X的强 | |
| C. | Y的简单离子与X的简单离子具有相同的电子层结构 | |
| D. | W、X、Y 三种元素形成的化合物具有离子键和共价健 |
3. 下列各组物质中,满足图中所示物质一步转化关系的选项是( )
下列各组物质中,满足图中所示物质一步转化关系的选项是( )
 下列各组物质中,满足图中所示物质一步转化关系的选项是( )
下列各组物质中,满足图中所示物质一步转化关系的选项是( )| 选项 | X | Y | Z |
| A | Na | NaOH | Na2CO3 |
| B | Cu | CuCl2 | Cu(OH)2 |
| C | Mg | MgO | MgCl2 |
| D | Al | Al2O3 | Al(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
4. 已知缬氨酸的结构简式如图,同分异构体中属于氨基酸的有(不考虑立体异构)( )
已知缬氨酸的结构简式如图,同分异构体中属于氨基酸的有(不考虑立体异构)( )
 已知缬氨酸的结构简式如图,同分异构体中属于氨基酸的有(不考虑立体异构)( )
已知缬氨酸的结构简式如图,同分异构体中属于氨基酸的有(不考虑立体异构)( )| A. | 10种 | B. | 11种 | C. | 12种 | D. | 13种 |


 、
、 、
、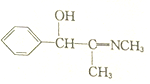
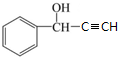 ,其核磁共振氢谱显示为6组峰,峰面积之比为1:2:2:1:1:1.
,其核磁共振氢谱显示为6组峰,峰面积之比为1:2:2:1:1:1.
 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$
 的路线(无机试剂任选):
的路线(无机试剂任选): .
.