题目内容
13.下列说法正确的是( )| A. | 一定条件下 2SO2(g)+O2(g)?2SO3(g)△H<0达到平衡,降温时,v (O2)正比v (O2)逆减小的程度大 | |
| B. | 在 0.1mol•L-1 NaHCO3 溶液中,加入少量 NaOH 固体,Na+、CO32- 的离子浓度均增大 | |
| C. | 增大反应物浓度,可增大活化分子百分数,从而使有效碰撞次数增多 | |
| D. | 电解精炼铜时,若阳极质量减少32g,则阴极转移的电子一定为 1mol |
分析 A.△H<0为放热反应,降温时,平衡正向移动;
B.NaHCO3 溶液中加入少量 NaOH 固体,反应生成碳酸钠;
C.增大反应物浓度,活化分子数目增多;
D.电解精炼铜时,阳极上Cu、Zn、Fe等均失去电子.
解答 解:A.△H<0为放热反应,降温时,平衡正向移动,则v (O2)逆 比v (O2)正减小的程度大,即降低温度后正反应速率大于逆反应速率,故A错误;
B.NaHCO3 溶液中加入少量 NaOH 固体,反应生成碳酸钠,则Na+、CO32- 的离子浓度均增大,故B正确;
C.增大反应物浓度,活化分子数目增多,从而使有效碰撞次数增多,则反应速率加快,故C错误;
D.电解精炼铜时,阳极上Cu、Zn、Fe等均失去电子,阴极上只有铜离子得到电子,则若阳极质量减少32g,则阴极转移的电子不一定为 1mol,故D错误;
故选B.
点评 本题考查较综合,涉及平衡移动、反应速率、电解原理,为高频考点,把握温度对平衡移动的影响、活化理论、粗铜精炼时阳极反应为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
3.下列关于常见有机物的说法正确的是( )
| A. | 多糖和纤维素互为同分异构体 | |
| B. | 糖类、油脂、蛋白质均可以形成高分子化合物 | |
| C. | 聚氯乙烯可用作生产食品包装材料的原料 | |
| D. | 分子式为C4H10O的有机物,只有2种能被氧化为醛 |
4.下列说法正确的是( )
| A. | 金属氧化物一定是碱性氧化物 | |
| B. | 胶体和其他分散系的本质区别是分散质粒子大小不同 | |
| C. | 混合物肯定由两种以上元素组成 | |
| D. | 酸性氧化物一定是非金属氧化物 |
1.下列叙述正确的是( )
| A. | 根据核磁共振氢谱不能鉴别1-溴丙烷和2-溴丙烷 | |
| B. | 沸点:CH3CH3>CH3CH2OH;密度: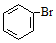 > >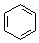 | |
| C. | 苯酚钠溶液中通入少量的CO2离子方程式为:C6H5O-+H2O+CO2→C6H5OH+CO32- | |
| D. | 要检验溴乙烷中的溴元素,向其中加入NaOH溶液共热,冷却后先加硝酸酸化,再加入硝酸银溶液,观察有无浅黄色沉淀生成 |
8. 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍:Y与Z能形成Z2Y、Z2Y2 型离子化合物,Z与T形成的Z2T化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断不正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍:Y与Z能形成Z2Y、Z2Y2 型离子化合物,Z与T形成的Z2T化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断不正确的是( )
 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍:Y与Z能形成Z2Y、Z2Y2 型离子化合物,Z与T形成的Z2T化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断不正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍:Y与Z能形成Z2Y、Z2Y2 型离子化合物,Z与T形成的Z2T化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断不正确的是( )| A. | Y、Z组成的化合物只含离子键 | |
| B. | 氢化物的沸点和稳定性排序:R<Y | |
| C. | 最高价氧化物对应的水化物的酸性:T>R | |
| D. | 由X、Y、Z、T四种元素组成的化合物水溶液一定显酸性 |
18.25℃,两种酸的电离平衡常数如下表.
①0.10mol•L-1NaHSO3溶液中离子浓度由大到小的顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
②向NaHCO3溶液中通入少量二氧化硫时反应的离子方程式为SO2+HCO3-=HSO3-+CO2 .
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②向NaHCO3溶液中通入少量二氧化硫时反应的离子方程式为SO2+HCO3-=HSO3-+CO2 .
7.相对分子质量为86的烷烃,有几种同分异构体( )
| A. | 6 | B. | 5 | C. | 4 | D. | 3 |


 、
、 、
、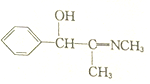
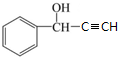 ,其核磁共振氢谱显示为6组峰,峰面积之比为1:2:2:1:1:1.
,其核磁共振氢谱显示为6组峰,峰面积之比为1:2:2:1:1:1.
 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$
 的路线(无机试剂任选):
的路线(无机试剂任选): .
.