题目内容
19.下列对于硝酸的认识,不正确的是( )| A. | 浓硝酸和稀硝酸都具有氧化性 | B. | 铜与硝酸的反应属于置换反应 | ||
| C. | 硝酸可氧化Fe2+ | D. | 可用铁或铝制品盛装浓硝酸 |
分析 A.浓硝酸,稀硝酸具有强氧化性;
B.铜与硝酸发生的氧化还原反应生成硝酸铜一氧化氮和水;
C.硝酸具有强氧化性,Fe2+具有还原性;
D.铁和铝在常温下遇浓硝酸发生钝化现象.
解答 解:A.浓硝酸和稀硝酸氮元素具有最高价,发生化学反应元素化合价只降低,都具有氧化性,故A正确
B.置换反应是一种单质和一种化合物反应生成另一种单质和一种化合物,铜与硝酸发生的氧化还原反应生成硝酸铜一氧化氮和水,不是置换反应,故B错误;
C.硝酸具有强氧化性,Fe2+具有还原性,二者可发生氧化还原反应,故C正确;
D.铁和铝在常温下遇浓硝酸发生钝化现象,阻止反应进行,常温下可用铁或铝制品盛装浓硝酸,故D正确;
故选B.
点评 本题考查了元素化合物知识,为高频考点,侧重于双基的考查,注意浓硝酸、稀硝酸都具有强的氧化性,题目难度不大.

练习册系列答案
相关题目
10.在温度不变的条件下,密闭容器中发生如下反应:2A(g)+3B(g)=2C(g),下列叙述不能够说明反应已经达到平衡状态的是( )
| A. | 2vB正=3vA正 | |
| B. | 3vC正=2vB逆 | |
| C. | 容器中气体的平均相对分子质量不再改变 | |
| D. | 反应容器中压强不随时间变化 |
14.下列说法正确的是( )
| A. | 元素周期律是按相对原子质量逐渐增大的顺序从左到右排列的 | |
| B. | 最外层电子数相同的元素都是同一族 | |
| C. | 同周期元素原子的电子层数相同数一定相同 | |
| D. | 非金属元素的最外层电子数都大于或等于4 |
11.下列各组中的四种物质,只用一种试剂即可鉴别的是( )
| A. | 淀粉溶液、乙醇、苯、四氯化碳 | B. | 乙烯、乙烷、乙炔、丙烯 | ||
| C. | 甲酸、乙醛、乙醇、乙酸 | D. | 苯酚、溴苯、苯、甲苯 |
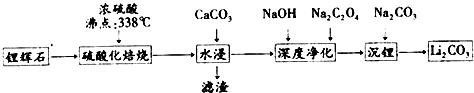
5.碳酸锂(相对分子质量74)广泛应用于化工、冶金、陶瓷、医药、制冷、焊接、锂合金等行业.制备流程如图:
已知:碳酸锂的溶解度为(g/L)
(1)锂辉石(Li2Al2Si4Ox)可以用氧化物的形式表示其组成,形式为Li2O•Al2O3•4SiO2
(2)硫酸化焙烧工业反应温度控制在250-300℃,主要原因是温度低于250℃,反应速率较慢,温度高于300℃,硫酸挥发较多;同时,硫 酸用量为理论耗酸量的115%左右,硫酸如果加入过多则ABC(填入选项代号).
A.增加酸耗量 B.增加后续杂质的处理量 C.增加后续中和酸的负担
(3)水浸时,需要在搅拌下加入石灰石粉末的主要作用是除去多余的硫酸,同时调整pH,除去大部分杂质.
(4)“沉锂”的化学反应方程式为Na2CO3+Li2SO4=Li2CO3↓+Na2SO4
(5)“沉锂”需要在95℃以上进行,主要原因是温度越高,碳酸锂溶解度降低,可以增加产率.过滤碳酸锂所得母液 中主要含有硫酸钠,还可能含有碳酸钠和碳酸锂.

已知:碳酸锂的溶解度为(g/L)
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
(2)硫酸化焙烧工业反应温度控制在250-300℃,主要原因是温度低于250℃,反应速率较慢,温度高于300℃,硫酸挥发较多;同时,硫 酸用量为理论耗酸量的115%左右,硫酸如果加入过多则ABC(填入选项代号).
A.增加酸耗量 B.增加后续杂质的处理量 C.增加后续中和酸的负担
(3)水浸时,需要在搅拌下加入石灰石粉末的主要作用是除去多余的硫酸,同时调整pH,除去大部分杂质.
(4)“沉锂”的化学反应方程式为Na2CO3+Li2SO4=Li2CO3↓+Na2SO4
(5)“沉锂”需要在95℃以上进行,主要原因是温度越高,碳酸锂溶解度降低,可以增加产率.过滤碳酸锂所得母液 中主要含有硫酸钠,还可能含有碳酸钠和碳酸锂.


 如图所示是原电池的装置图(
如图所示是原电池的装置图( 为电流表).请回答:
为电流表).请回答: