题目内容
18.已知某有机物的结构如图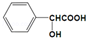
(1)该有机物中官能团的名称是醇羟基和羧基
(2)1mol该有机物与足量NaOH反应的化学方程式是
 +NaOH→
+NaOH→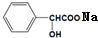 +H2O.
+H2O.
分析 (1)该有机物中官能团为醇羟基和羧基;
(2)能和NaOH反应的是羧基,与NaOH发生中和反应.
解答 解:(1)该有机物中官能团为醇羟基和羧基,故答案为:醇羟基和羧基;
(2)能和NaOH反应的是羧基,与NaOH发生中和反应,反应方程式为 +NaOH→
+NaOH→ +H2O,
+H2O,
故答案为: +NaOH→
+NaOH→ +H2O.
+H2O.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查醇、羧酸性质,能与NaOH溶液反应的官能团有羧基、酚羟基和酯基,注意总结归纳.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
8.下列反应属于吸热反应的是( )
| A. | 铝片与硫酸的反应 | |
| B. | 氢气在氧气中燃烧 | |
| C. | 氢氧化钾和硫酸中和 | |
| D. | 碳酸钙高温分解成氧化钙和二氧化碳 |
9.下列有关说法不正确的是( )
| A. | 油脂在碱性条件下水解又可称为皂化反应 | |
| B. | 甲醛和硫酸铵溶液均能使蛋白质变性 | |
| C. | 标准状况下,22.4 L乙烯质量为28 g | |
| D. | 1 mol 甲基所含电子数为9NA |
6.关于原子轨道的说法正确的是( )
| A. | 凡是中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体 | |
| B. | CH4分子中的sp3杂化轨道是由4个H原子的1s 轨道和C原子的2p轨道混合起来而形成的 | |
| C. | 乙炔分子中,两个碳原子均采用sp2杂化轨道成键 | |
| D. | sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混合起来形成的一组能量相等的新轨道 |
13.下列有关原子结构和元素周期律的表述正确的是( )
| A. | 同周期非金属元素的氧化物对应的水化物的酸性从左到右依次增强 | |
| B. | 第ⅠA 族元素的金属性比第ⅡA 族元素的金属性强 | |
| C. | ⅦA族元素是同周期中非金属性最强的元素 | |
| D. | 原子序数为15的元素的最高化合价为+3 |
3.X、Y、Z、W是短周期中的四种常见元素,其相关信息如表:
(1)Y位于元素周期表第三周期第VIA族,Y和Z的最高价氧化物对应的水化物的酸性较强的是HClO4(写最高价氧化物对应的水化物的化学式).
(2)W可以生成两种氧化物,分别写出这两种氧化物的电子式: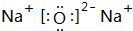 、
、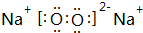 ;
;
(3)用电子式表示Y和 W形成离子化合物的过程 写出X元素的最高价氧化物的电子式
写出X元素的最高价氧化物的电子式 .
.
| 元素 | 相关信息 |
| X | X最外层电子数是次外层电子数的2倍 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的非金属性大于Y |
| W | W的一种核素的质量数为23,中子数为12 |
(2)W可以生成两种氧化物,分别写出这两种氧化物的电子式:
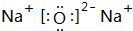 、
、 ;
; (3)用电子式表示Y和 W形成离子化合物的过程
 写出X元素的最高价氧化物的电子式
写出X元素的最高价氧化物的电子式 .
.
8.标准状况下,气体摩尔体积约为22.4L/mol.则标准状况下0.5molCO2所占的体积约是﹙)
| A. | 2.24L | B. | 11.2L | C. | 22.4L | D. | 44.8L |
 酯;
酯;  酚;
酚; 醛;
醛; 卤代烃;
卤代烃; 羧酸.
羧酸.