题目内容
10.将反应2Fe3++Fe═3Fe2+设计成原电池,电池负极材料为Fe,正极反应为2Fe3++2e-=2Fe2+.分析 根据方程式知,该反应中Fe失电子发生氧化反应,则Fe作负极,不如Fe活泼的金属或导电的非金属作正极,含有铁离子的可溶性铁盐作电解质,据此分析解答.
解答 解:根据方程式知,该反应中Fe失电子发生氧化反应,则Fe作负极,不如Fe活泼的金属或导电的非金属作正极,含有铁离子的可溶性铁盐作电解质,正极上铁离子得电子发生还原反应,电极反应式为2Fe3++2e-=2Fe2+,
故答案为:Fe;2Fe3++2e-=2Fe2+.
点评 本题考查原电池设计,为高频考点,明确原电池原理是解本题关键,明确元素化合价变化与正负极关系是解本题关键,会根据电池反应式确定正负极材料和电解质,题目难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
20.下列叙述中能肯定说明金属A比金属B的活泼性强的是( )
| A. | A原子最外层外层电子数比B原子最外层外层电子数少 | |
| B. | A原子电子层数比B原子电子层数多 | |
| C. | 常温时,A能从酸中置换出氢,而B不能 | |
| D. | 1molA从酸中置换生成的氢气比1molB从酸中置换生成的氢气多 |
1.将10mL某气态的烃,在60mLO2里充分燃烧,得到液态水和体积为45mL的混合气体,则该烃可能为( )
| A. | 甲烷 | B. | 乙烷 | C. | 丙烷 | D. | 丁烯 |
15.关于如图所示的原电池,下列说法不正确的是( )
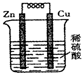

| A. | 铜片为正极,锌片为负极 | B. | 锌片溶解,质量减少 | ||
| C. | 铜片上有气泡产生 | D. | 电子由铜片经导线流向锌片 |
2.现在部分短周期元素的性质或原子结构如下表:
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是14C.
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒的化学式NH4+(用元素符号表示).
(3)探寻物质的性质差异是学习的重要方法之一,T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是H2CO3(填化学式).Z的最高价氧化物对应的水化物与W的最高价氧化物对应的水化物反应的离子方程式为Al(OH)3+3H+=Al3++3H2O.
元素Z与元素T相比,非金属较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是②.
①常温下Z的单质和T的单质状态不同
②Z的氢化物比T的氢化物稳定
③一定条件下Z和T的单质都能与氢氧化钠溶液反应.
| 元素编号 | 元素性质或原子结构 |
| T | M层上有6个电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
| W | 其单质既能跟酸反应,又能跟碱反应,都产生H2 |
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒的化学式NH4+(用元素符号表示).
(3)探寻物质的性质差异是学习的重要方法之一,T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是H2CO3(填化学式).Z的最高价氧化物对应的水化物与W的最高价氧化物对应的水化物反应的离子方程式为Al(OH)3+3H+=Al3++3H2O.
元素Z与元素T相比,非金属较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是②.
①常温下Z的单质和T的单质状态不同
②Z的氢化物比T的氢化物稳定
③一定条件下Z和T的单质都能与氢氧化钠溶液反应.
19.在进行有关物质性质的探究实验时,下列实验能够达到实验目的是( )
| A. | 将宽度0.2~0.3cm的铝条在酒精灯火焰上灼烧片刻,可观察到铝条马上剧烈燃烧 | |
| B. | 为了培养大颗粒的明矾晶体,配制90℃的饱和溶液后骤冷 | |
| C. | 做乙醇170℃时的脱水实验制取乙烯时,为使烧瓶受热均匀,温度慢慢上升到170℃ | |
| D. | 为了检验某工业废水中的酚类物质是否存在,用三氯化铁溶液检验 |
20.关于反应2NaBr+Cl2═2NaCl+Br2,下列说法不正确 的是( )
| A. | Cl2是氧化剂,反应中Cl得到电子 | |
| B. | 当1 mol Cl2完全反应时,有2 mol电子发生转移 | |
| C. | NaBr是还原剂,反应中Br-得到电子 | |
| D. | 当1 mol NaBr完全反应时,有1 mol电子发生转移 |
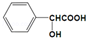
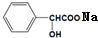 +H2O.
+H2O. 3,3,4-三甲基己烷.
3,3,4-三甲基己烷.