题目内容
2.用1~18号元素及其形成化合物的化学式填空(1)除稀有气体外,原子半径最大的元素是Na,它的原子结构示意图是

(2)与水反应最剧烈的金属是Na
(3)气态氢化物的水溶液呈碱性的元素是N
(4)最稳定的气态氢化物是HF.
分析 (1)原子的电子层数越少,其原子半径越小,同一周期元素中,原子半径随着原子序数增大而减小;
(2)金属性越强与水反应越剧烈,金属性最强的元素是Na元素;
(3)气态氢化物的水溶液呈碱性的气体是NH3;
(4)非金属性越强,气态氢化物越稳定.
解答 解:(1)原子的电子层数越少,其原子半径越小,同一周期元素中,原子半径随着原子序数增大而减小,最大的是Na元素,
钠原子结构示意图为 ,故答案为:Na;
,故答案为:Na; ;
;
(2)金属性最强的元素是Na元素,金属性越强,性质越活泼,与水反应越剧烈,故答案为:Na;
(3)气态氢化物的水溶液呈碱性的气体是NH3,所以元素是氮元素,故答案为:N;
(4)非金属性越强,气态氢化物越稳定,F元素的非金属性最强,故氟化氢最稳定,故答案为:HF.
点评 本题考查了元素周期表及元素周期律综合应用,涉及化学式、原子结构等化学用语,再结合元素周期律分析解答,题目难度不大.

练习册系列答案
相关题目
13.将1.92g 铜粉加入到40mL 1mol•L-1的稀硝酸溶液中,充分反应后,再向溶液中加入下列物质,充分搅拌后,铜粉仍然不能完全溶解的是( )
| A. | 40mL 1 mol•L-1的稀硝酸溶液 | B. | 40mL 0.5 mol•L-1的稀硫酸溶液 | ||
| C. | 40mL 1 mol•L-1的FeCl3溶液 | D. | 60mL 0.5 mol•L-1的稀盐酸 |
10.下列有关叙述中正确的是( )
| A. | 强电解质在水溶液中的电离过程是不可逆的 | |
| B. | 强电解质的水溶液导电能力一定比弱电解质水溶液的导电能力强 | |
| C. | 易溶于水的电解质一定是强电解质 | |
| D. | 难溶于水的电解质一定是弱电解质 |
14. 海底热液研究处于当今科研的前沿.海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿及锌矿等矿物.
海底热液研究处于当今科研的前沿.海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿及锌矿等矿物.
(1)Fe2+的核外电子排布式是[Ar]3d6或1s22s22p63s23p63d6.
(2)分析下表,铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,主要原因是气态Cu失去一个电子变成结构为[Ar]3d10的Cu+,能量较低,所以Cu的第二电离能相对较大(或气态Zn失去一个电子变成结构为[Ar]3d104s1的Zn+,易再失去一个电子,所以Zn的第二电离能相对较小).
(3)下列说法正确的是BCD.
A.电负性:N>O>S>C
B.CO2与COS(硫化羰)互为等电子体
C.NH3分子中氮原子采用sp3杂化
D.CO、H2S、HCN都是极性分子
(4)CH4与元素X的一种含氢粒子互为等电子体,元素X的这种含氢粒子的化学式是NH4+.
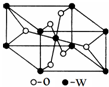
(5)W的原子序数为22,它的一种氧化物晶胞结构如图所示,该氧化物的化学式为TiO2.
(6)在浓的WCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为WCl3•6H2O的绿色晶体,该晶体中两种配位体的物质的量之比为1:5,则该配合物的化学式为[TiCl(H2O)5]Cl2•H2O.
 海底热液研究处于当今科研的前沿.海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿及锌矿等矿物.
海底热液研究处于当今科研的前沿.海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿及锌矿等矿物.(1)Fe2+的核外电子排布式是[Ar]3d6或1s22s22p63s23p63d6.
(2)分析下表,铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,主要原因是气态Cu失去一个电子变成结构为[Ar]3d10的Cu+,能量较低,所以Cu的第二电离能相对较大(或气态Zn失去一个电子变成结构为[Ar]3d104s1的Zn+,易再失去一个电子,所以Zn的第二电离能相对较小).
| 电离能/kJ•mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
A.电负性:N>O>S>C
B.CO2与COS(硫化羰)互为等电子体
C.NH3分子中氮原子采用sp3杂化
D.CO、H2S、HCN都是极性分子
(4)CH4与元素X的一种含氢粒子互为等电子体,元素X的这种含氢粒子的化学式是NH4+.
(5)W的原子序数为22,它的一种氧化物晶胞结构如图所示,该氧化物的化学式为TiO2.
(6)在浓的WCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为WCl3•6H2O的绿色晶体,该晶体中两种配位体的物质的量之比为1:5,则该配合物的化学式为[TiCl(H2O)5]Cl2•H2O.