题目内容
9.已知H2SO3+I2+H2O=H2SO4+2HI,将0.1molCl2通入100mL含等物质的量的HI与H2SO3的混合溶液中,有一半的HI被氧化,则下列说法正确的是( )| A. | 物质的还原性:HI>H2SO3>HCl | |
| B. | HI与H2SO3的物质的量浓度为0.6 mol•L-1 | |
| C. | 通入0.1molCl2发生反应的离子方程式为:5Cl2+4H2SO3+2I-+4H2O=4SO42-+I2+10Cl-+16H+ | |
| D. | 若再通入0.05molCl2,恰好能将HI和H2SO3完全氧化 |
分析 由H2SO3+I2+H2O=H2SO4+2HI可知还原性H2SO3>HI,则0.1molCl2通入100mL含等物质的量的HI与H2SO3的混合溶液中,有一半的HI被氧化,设HI的物质的量为x,由电子守恒可知,0.1mol×2=x×0.5×1+x×(6-4),解得x=0.08mol,以此来解答.
解答 解:由H2SO3+I2+H2O=H2SO4+2HI可知还原性H2SO3>HI,则0.1molCl2通入100mL含等物质的量的HI与H2SO3的混合溶液中,有一半的HI被氧化,设HI的物质的量为x,由电子守恒可知,0.1mol×2=x×0.5×1+x×(6-4),解得x=0.08mol,
A.由H2SO3+I2+H2O=H2SO4+2HI及还原剂的还原性大于还原产物的还原性可知还原性H2SO3>HI,故A错误;
B.由上述计算可知,HI的物质的量为0.08mol,溶液体积为0.1L,浓度为0.8mol/L,故B错误;
C.通入0.1molCl2发生反应的离子方程式为5Cl2+4H2SO3+2I-+4H2O=4SO42-+I2+10Cl-+16H+,遵循电子、电荷守恒,故C正确;
D.由上述分析可知,还有0.04molHI未被氧化,则再通入0.02molCl2,恰好能将HI和H2SO3完全氧化,故D错误,
故选C.
点评 本题考查氧化还原反应及计算,为高频考点,把握氧化的先后顺序、电子守恒为解答的关键,侧重分析与应用能力的考查,注意利用信息判断还原性,题目难度不大.

练习册系列答案
相关题目
19.一定温度下,测定某溶液中只含NH4+、Cl-、H+、OH-四种离子,下列说法一定正确的是( )
| A. | 溶液中四种粒子之间满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-) | |
| B. | 若溶液中粒子间满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶液中溶质为:NH3•H2O和NH4Cl | |
| C. | 若溶液中粒子间满足:c(Cl-)>c(NH4+)>c(H+)>c(OH-),则溶液中溶质只有NH4Cl | |
| D. | 若溶液中c(NH4+)=c(Cl-),则该溶液pH等于7. |
20.下列图象表达正确的是( )
| A. | 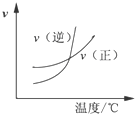 某可逆反应的正反应是吸热反应 | B. | 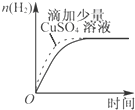 等量的锌粉与足量的盐酸反应 | ||
| C. | 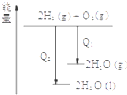 氯气和氧气反应中的能量变化 | D. | 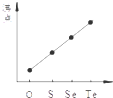 气态氢化物沸点 |
17.已知2Fe3++2I-=2Fe2++I2,Br2+2Fe2+=2Br-+2Fe3+.往含有FeBr2、FeI2的混合液中通入一定量的氯气后,再滴加少量的KSCN溶液,溶液变为红色,则下列说法不正确的是( )
| A. | 按I-、Fe2+、Br-的顺序还原性逐渐减弱 | |
| B. | 通入氯气后原溶液中Fe2+一定被氧化 | |
| C. | 原溶液中Br-一定被氧化 | |
| D. | 不能确定通入氯气后的溶液中是否还存在Fe2+ |
4.X、Y、Z是3种短周期元素,其中X、Z位于同一主族.X原子的最外层电子数是其电子层数的3倍.X原子的核外电子数比Y原子少1.下列说法正确的是( )
| A. | 原子半径由大到小的顺序为Z>X>Y | |
| B. | Z元素的氢化物是一种强酸 | |
| C. | 元素非金属性由强到弱的顺序为X>Y>Z | |
| D. | 3种元素的气态氢化物中,Y的气态氢化物还原性最强 |
14.下列有机反应中,哪一个反应与其它三个反应的反应类型不同的是( )
| A. | CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O | |
| B. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| C. | CH3CH2Br+NaOH$\stackrel{H_{2}O}{→}$CH3CH2OH+NaBr | |
| D. | 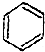 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$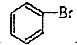 +HBr +HBr |
3.已知碳碳单键可以绕键轴自由旋转,对结构简式为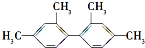 的烃,下列说法正确的是( )
的烃,下列说法正确的是( )
 的烃,下列说法正确的是( )
的烃,下列说法正确的是( )| A. | 分子中至少有9个碳原子处于同一平面上 | |
| B. | 分子中至少有11个碳原子处于同一平面上 | |
| C. | 分子中至少有16个碳原子处于同一平面上 | |
| D. | 该烃的苯环上的一氯代物有5种 |
1.某主族元素在周期表中的位置,取决于元素原子的( )
| A. | 相对原子质量和核电荷数 | B. | 电子层数和核内中子数 | ||
| C. | 电子层数和最外层电子数 | D. | 金属性和非金属性的强弱 |