题目内容
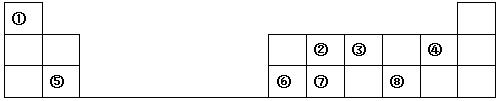
4.A~H八种短周期主族元素在周期表中的相对位置如下图所示,已知C元素形成的单质有“国防金属”的美誉,E的最高价氧化物对应的水化物能与E的最简单氢化物反应生成离子化合物.
(1)写出B、G对应的元素符号Na、S.
(2)D元素在周期表中的位置为第二周期第ⅣA族.
(3)B、E、F的简单离子半径由大到小的顺序为r(N3-)>r(O2-)>r(Na+)(或N3->O2->Na+)(写离子符号).
(4)上述元素所形成的气态单质中能用于饮用水消毒的是Cl2或O3(写化学式).
(5)B的单质在F的单质中燃烧的火焰颜色为黄色,所形成化合物的电子式为
 .
.(6)C元素的单质可以在D和F组成的一种气态化合物中燃烧,写出该反应的化学方程式2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
分析 A~H为八种短周期主族元素,C元素形成的单质有“国防金属”的美誉,C为Mg;E的最高价氧化物对应的水化物能与E的最简单氢化物反应生成离子化合物,E为N元素,结合元素在周期表的位置可知,A为Li,B为Na,D为C,F为O,G为S,H为Cl.
(1)B为Na,G为S;
(2)D为C,位于第二周期第ⅣA族;
(3)具有相同电子排布的离子中,原子序数大的离子半径小;
(4)氯气、臭氧均可用于水的杀菌消毒;
(5)钠燃烧火焰为黄色,生成过氧化钠;
(6)Mg与二氧化碳反应生成MgO和C.
解答 解:(1)B为Na,G为S,故答案为:Na、S;
(2)D元素在周期表中的位置为第二周期第ⅣA族,故答案为:第二周期第ⅣA族;
(3)B、E、F的简单离子半径由大到小的顺序为r(N3-)>r(O2-)>r(Na+)(或N3->O2->Na+),故答案为:r(N3-)>r(O2-)>r(Na+)(或N3->O2->Na+);
(4)上述元素所形成的气态单质中能用于饮用水消毒的是Cl2或O3,故答案为:Cl2或O3;
(5)B的单质在F的单质中燃烧的火焰颜色为黄色,所形成化合物的电子式为 ,故答案为:黄色;
,故答案为:黄色; ;
;
(6)Mg与二氧化碳反应生成MgO和C,反应方程式为2Mg+CO2 $\frac{\underline{\;点燃\;}}{\;}$2MgO+C,故答案为:2Mg+CO2 $\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素的性质、元素周期律、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
3.下列反应属于取代反应的是(一定条件下)( )
| A. | CH4+2O2→CO2+2H2O | |
| B. | CH2=CH2+Br2→BrCH2CH2Br | |
| C. | CH3CH2CH2Cl+NaOH→CH3CH=CH2+NaCl+H2O | |
| D. |  -Cl+H2O→ -Cl+H2O→ -OH+HCl -OH+HCl |
4.下列离子方程书写正确的是( )
| A. | 铝与烧碱溶液反应:Al+2OH-=AlO2-+H2↑ | |
| B. | 碳酸钙与醋酸反应:CaCO3+2H+=Ca2++CO2↑+H2O | |
| C. | 过量CO2气体通入次氯酸钙溶液中:CO2+2ClO-+H2O=CO32-+2 HClO | |
| D. | 氯化铁溶液呈酸性:Fe3++3H2O?Fe(OH)3+3 H+ |
12. 双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源.利用双极膜电渗析法电解食盐水可获得淡水、NaOH和HC1,其工作原理如图所示,M、N为离子交换膜.下列说法错误的是( )
双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源.利用双极膜电渗析法电解食盐水可获得淡水、NaOH和HC1,其工作原理如图所示,M、N为离子交换膜.下列说法错误的是( )
 双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源.利用双极膜电渗析法电解食盐水可获得淡水、NaOH和HC1,其工作原理如图所示,M、N为离子交换膜.下列说法错误的是( )
双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源.利用双极膜电渗析法电解食盐水可获得淡水、NaOH和HC1,其工作原理如图所示,M、N为离子交换膜.下列说法错误的是( )| A. | 阴极室发生的反应为2H++2e-=H2↑ | |
| B. | M为阳离子交换膜,N为阴离子交换膜 | |
| C. | 若去掉双极膜(BP),阳极室会有C12生成 | |
| D. | 电路中每转移1mol电子,两极共得到0.5 mol气体 |
13.仅用一种试剂鉴别如下物质:苯、四氯化碳、碘化钠溶液、氯化钠溶液、亚硫酸钠溶液.下列试剂不能选用的是( )
| A. | 溴水 | B. | 氯化铁溶液 | ||
| C. | 酸性高锰酸钾溶液 | D. | 硝酸银溶液 |
14.下列说法正确的是( )
| A. | KAl(SO4)2 溶液中 c(K+)=2c(SO42-) | |
| B. | 向NaHCO3溶液中加入少量Ba(OH)2固体,c(CO32-)增大 | |
| C. | 含有A gCl 和A gBr 固体的悬浊液中,C(Ag+)>c(Cl-)=c(Br-) | |
| D. | 若使Na2S溶液中$\frac{{c(N{a^+})}}{{c({S^{2-}})}}$接近于2:1,可加入适量的NaOH固体 |
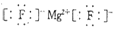 .
. 如表为元素周期表的一部分.
如表为元素周期表的一部分.