题目内容
4.填写表| 物质 | 摩尔质量 | 物质的量 | 质量 | 分子或 离子数目 |
| SO2 | 64g/mol | 2mol | 128g | 1.204×1024 |
| SO${\;}_{4}^{2-}$ | 96g/mol | 10mol | 960g | 6.02×1024 |
分析 摩尔质量是单位物质的量的物质质量,即1mol物质的质量单位g/mol,数值上等于其相对分子质量,依据n=mM计算,
物质的量是国际基本物理量,用来表示微观粒子数目集体的物理量,单位mol,m=nM,
质量单位g,
分子或离子数依据阿伏伽德罗常数计算,n=$\frac{N}{{N}_{A}}$;
解答 解:SO2 摩尔质量=64g/mol,2molSO2的质量=nM=2mol×64g/mol=128g,分子数=nNA=2mol×6.02×1023/mol=1.204×1024,
SO42-离子物质的量=$\frac{6.02×1{0}^{24}}{6.02×1{0}^{23}}$=10mol,摩尔质量=(32+16×4)g/mol=96g/mol,质量=nM=10mol×96g/mol=960g,
故答案为:
| 物质 | 摩尔质量 | 物质的量 | 质量 | 分子或 离子数目 |
| SO2 | 64g/mol | 128g | 1.204×1024 | |
| SO${\;}_{4}^{2-}$ | 96g/mol | 10mol, | 96g |
点评 本题考查了物质的量、摩尔质量、微粒数、质量之间的计算关系,掌握基础是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.“pp”塑料(聚丙烯)是保鲜盒的材料,用1-丙醇制取 ,可能遇到的反应类型是( )
,可能遇到的反应类型是( )
 ,可能遇到的反应类型是( )
,可能遇到的反应类型是( )| A. | 取代 | B. | 消去 | C. | 缩聚 | D. | 氧化 |
15.下列关于化学反应速率说法正确的是( )
| A. | 化学反应速率是指一定时间内任何一种反应物浓度的减小或任何一种生成物浓度的增加 | |
| B. | 根据化学反应速率的大小可以知道化学反应进行的快慢 | |
| C. | 化学反应速率0.8 mol/(L•s)是指1 s时某物质的浓度为0.8 mol/L | |
| D. | 对于任何化学反应来说,反应速率越大,反应现象就越明显 |
12.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1mol/L的KI溶液:NH4+、H+、SO42-、NO3- | |
| B. | 某澄清透明的溶液:Fe3+、Mg2+、SO42-、Cl- | |
| C. | 0.1mol/LNaClO溶液:NH4+、Fe2+、SO42-、NO3- | |
| D. | 0.1mol/L的氨水:Cu2+、K+、Cl-、NO3- |
19.下列固体投入水中,有气体产生的是( )
| A. | Na2O2 | B. | Na2O | C. | NaHCO3 | D. | Na2CO3 |
9.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 1 L 0.1 mol•L-1的氨水中有0.1NA个NH4+ | |
| C. | 常温常压下,8 g O2含有4 NA个电子 | |
| D. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA |
12.下列化学方程式或离子方程式正确的是( )
| A. | 用过量氨水吸收工业尾气中的SO2:2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| B. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| C. | 向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO42-═BaSO4↓ | |
| D. | 常温下,将铁片置于浓硝酸中:Fe+6HNO3═Fe(NO3)3+3NO2↑+3H2O |
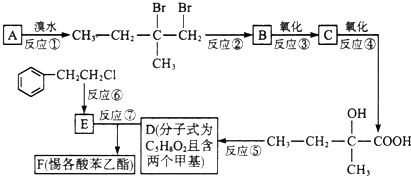
 ;F的结构简式为
;F的结构简式为 .
.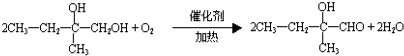 .
.