题目内容
9.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 1 L 0.1 mol•L-1的氨水中有0.1NA个NH4+ | |
| C. | 常温常压下,8 g O2含有4 NA个电子 | |
| D. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA |
分析 A.次氯酸根离子部分水解,溶液中次氯酸根离子数目减少;
B.氨水是弱电解质,电离是微弱的;
C.求出氧原子的物质的量,然后根据1mol氧原子中含8mol电子来分析;
D.溶液体积不知不能依据浓度计算微粒数;
解答 解:A.1L 1mol•L-1的NaClO溶液中含有溶质次氯酸钠1mol,由于部分次氯酸根离子水解,则溶液中次氯酸根离子的物质的量小于1mol,含有ClO-的数目小于NA,故A错误;
B.氨水是弱电解质,电离是微弱的,1L0.1mol•L-1的氨水中有NH4+数目小于NA个,故B错误;
C.8g氧气中氧原子的物质的量n=$\frac{8g}{16g/mol}$=0.5mol,而1mol氧原子中含8mol电子,故0.5mol氧原子中含4mol电子即4NA个,故C正确;
D.25℃时pH=13的NaOH溶液中含有OH-的浓度为0.1mol/L,溶液体积不知不能计算氢氧根离子数,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的应用,主要考查盐类水解应用、弱电解质电离平衡、溶液中离子数的计算、气体摩尔体积的条件应用等知识点,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
17.下列元素符号所表示的元素不是非金属元素( )
| A. | Br | B. | Rb | C. | S | D. | P |
4.填写表
| 物质 | 摩尔质量 | 物质的量 | 质量 | 分子或 离子数目 |
| SO2 | 64g/mol | 2mol | 128g | 1.204×1024 |
| SO${\;}_{4}^{2-}$ | 96g/mol | 10mol | 960g | 6.02×1024 |
14.在酸性介质中,往MnSO4溶液里滴加(NH4)2S2O8溶液会发生如下离子反应(未配平):Mn2++S2O82一+H2O→MnO4一+SO42一+H+,下列说法不正确的是( )
| A. | 氧化性比较:S2O82 ->MnO4- | |
| B. | 氧化剂S2O82-的摩尔质量为 192 g/mol | |
| C. | 该反应中酸性介质可以为盐酸 | |
| D. | 若有0.1 mol氧化产物生成,则转移电子 0.5 mol |
1. 三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述不正确的是( )
三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述不正确的是( )
 三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述不正确的是( )
三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述不正确的是( )| A. | 当电路中通过4mol电子的电量时,生成有标准状况下的O2为22.4L | |
| B. | 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品 | |
| C. | 正极区反应为2H2O-4e-═O2+4H+,正极区溶液pH降低 | |
| D. | 通电后中间隔室的SO42-离子向负极区迁移,负极区溶液pH增大 |
17.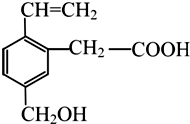 某有机物的结构如图所示,这种有机物具有的性质是( )
某有机物的结构如图所示,这种有机物具有的性质是( )
①可以与氢气发生加成反应;
②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应;
④能发生酯化反应;
⑤能发生加聚反应.
 某有机物的结构如图所示,这种有机物具有的性质是( )
某有机物的结构如图所示,这种有机物具有的性质是( )①可以与氢气发生加成反应;
②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应;
④能发生酯化反应;
⑤能发生加聚反应.
| A. | 只有①④ | B. | 只有①④⑤ | C. | ①②③④ | D. | 全部 |
 硫化钠
硫化钠 氢氧化钠
氢氧化钠
 氮气
氮气 次氯酸
次氯酸 .
.