题目内容
2.次氯酸可用于杀菌消毒.已知25°C时:①HClO(aq)+OH-(aq)=ClO-(aq)+H2O(l);△H=-Q1kJ•mol-1
②H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1
下列说法正确的是( )
| A. | 已知酸性H2SO3>HClO>HSO3-,则向Na2SO3溶液中加入HClO的离子方程式为:SO32-+HClO=HSO3-+ClO- | |
| B. | PH=3的HClO溶液,加水稀释后,溶液中所有的离子浓度降低 | |
| C. | 在25°C时,次氯酸的电离方程式及热效应可表示为:HClO(aq)?H+(aq)+ClO-(aq);△H=-(57.3+Q1)kJ•mol-1 | |
| D. | 将20ml 1mol/L HClO溶液与10ml 1mol/L NaOH溶液混合后,所得的混合溶液中一定存在:2c(H+)-2c(OH-)=c(ClO-)-c(HClO) |
分析 A.次氯酸具有强氧化性与亚硫酸根离子发生氧化还原反应;
B.依据Kw=C(H+)C(OH-)分析判断;
C.依据盖斯定律计算解答;
D.依据电荷守恒、物料守恒解答.
解答 解:A.向Na2SO3溶液中加入HClO的离子方程式为:SO32-+HClO=SO42-+H++Cl-,故A错误;
B.温度不变,Kw不变,加水稀释PH=3的HClO溶液,氢离子浓度减小,则氢氧根离子浓度升高,故B错误;
C.根据盖斯定律,在25°C时,次氯酸的电离方程式及热效应可表示为:HClO(aq)=H+(aq)+ClO-(aq)△H=-(Q1-57.3)kJ•mol-1,故C错误;
D.B、将20mL 1mol/L HClO与10mL 1mol/L NaOH混合后所得的溶液是等浓度的次氯酸和次氯酸钠的混合物,根据电荷守恒:c(H+)+c(Na+)=c(OH-)+c(ClO-),根据物料守恒:2c(Na+)=c(ClO-)+c(HClO),整理两个等式得到2c(H+)-2c(OH-)=c(ClO-)-c(HClO),故D正确;
故选:D.
点评 本题为综合题,涉及离子方程式书写,利用盖斯定律计算反应热,溶液中守恒定律的应用等,题目难度较大,掌握相关知识是解题关键.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
12.某无色的溶液中存在如下四种离子:K+、SO42-、Al3+、和M,测得它们的物质的量之比依次为n(K+):n(SO42-):n(Al3+):n(M)=2:5:2:1,则M可能是( )
| A. | NO3- | B. | Cu2+ | C. | Mg2+ | D. | Ba2+ |
10.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法错误的是( )


| A. | 该反应的热化学方程式为:N2(g)+O2(g)=2NO(g)△H=+180 kJ•mol-1 | |
| B. | 1 mol N2(l)和NA个 O2(l)反应生成2mol NO(g)时,吸收的能量为180 kJ | |
| C. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 | |
| D. | 通常情况下,N2(g)和O2(g)混合不能直接生成NO(g) |
17.关于如图装置的说法正确的是( )
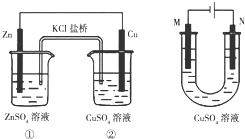

| A. | 装置①将电能转变为化学能 | |
| B. | 装置①中盐桥内的Cl-移向ZnSO4溶液 | |
| C. | 若装置②用于铁棒镀铜,则N极为铁棒 | |
| D. | 若装置②用于电解精炼铜,则溶液中的Cu2+浓度保持不变 |
7.下列每组分别给出了两个量,其中可以组成一个物质的量的公式的组有( )
| ① | ② | ③ | ④ | ⑤ |
| 物质微粒数 | 固体体积 | 溶液中溶质的质量分数 | 标准状况下气体的摩尔体积 | 非标准状况下某物质的质量 |
| 阿伏加德罗常数 | 固体密度 | 溶液体积 | 标准状况下气体的体积 | 物质的摩尔质量 |
| A. | ①②⑤ | B. | ②③④ | C. | ①④⑤ | D. | ①③④ |
11.足量铁粉与一定量的盐酸反应,能产生一定量的氢气.为减慢反应速率,但不影响H2的总量,可以加入下列物质中的( )
| A. | CuSO4 | B. | NaOH | C. | Na2CO3 | D. | CH3COONa |
1.下列说法正确的是( )
| A. | 碱金属单质的熔点随原子序数的增大而降低 | |
| B. | 金属元素的最外层电子数都小于4 | |
| C. | 已知硒(Se)位于第四周期第ⅥA族,其最高价氧化物对应水化物的化学式为H2SeO3 | |
| D. | 第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性 |