题目内容
5.以下是对金属及其化合物的讨论,根据要求回答问题:(1)中学所学的金属单质中,在冷的浓硫酸或浓硝酸中会发生钝化现象的有Fe、Al(填化学式).
(2)写出钠与水反应的离子方程式2Na+2H2O=2Na++2OH-+H2↑.
(3)在AlCl3溶液中逐滴滴入过量的NaOH溶液,观察到的现象是先生成白色沉淀,后沉淀消失,反应的离子方程式为Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O.
(4)铝分别与足量的NaOH溶液和稀硫酸反应,若两个反应在相同状况下放出等量的气体,则两个反应中消耗的铝的物质的量之比为1:1.
分析 (1)常温下在浓硫酸、浓硝酸溶液中发生钝化的金属有铝、铁等;
(2)钠和水反应生成氢氧化钠和氢气;
(3)氯化铝和氢氧化钠溶液反应,先生成氢氧化铝沉淀,氢氧化铝再和氢氧化钠溶液反应生成偏铝酸钠;
(4)根据转移电子守恒计算.
解答 解:(1)中学所学的金属单质中,在冷的浓硫酸或浓硝酸中会发生钝化现象的有Fe、Al,
故答案为:Fe、Al;
(2)钠与水反应生成氢氧化钠和氢气,反应的化学方程式为:2Na+2H2O=2Na++2OH-+H2↑;
故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(3)AlCl3中加入NaOH先生成Al(OH)3,发生Al3++3OH-═Al(OH)3↓,Al(OH)3具有两性,继续加入NaOH溶液则发生Al(OH)3+OH-═AlO2-+2H2O,可观察到沉淀溶解,
故答案为:先生成白色沉淀,后沉淀消失;Al3++3OH-═Al(OH)3↓;Al(OH)3+OH-═AlO2-+2H2O;
(4)铝分别和足量的氢氧化钠和稀硫酸反应,如果生成相同条件下等量的氢气,这两个反应中都是铝失电子,由转移电子守恒知,需要铝的物质的量之比为1:1,
故答案为:1:1.
点评 本题考查了离子方程式的书写、根据方程式的计算等知识点,明确离子方程式的书写规则是解本题关键,再结合转移电子守恒进行计算,会运用化学语言描述氯化铝和氢氧化钠过量溶液反应现象,如果将氯化铝滴入氢氧化钠溶液中产生的现象是:溶液先澄清后变浑浊,题目难度不大.

练习册系列答案
相关题目
16.在2L密闭容器中,充入2molSO2和一定量的O2,发生2SO2+O2═2SO3反应.进行到4mi n时,测得SO2为0.4mol,若反应进行到2min时,容器中的SO2为( )
| A. | 1.6mol | B. | 大于1.2 mol | C. | 大于1.6 mol | D. | 小于1.2 mol |
20.下列化学药品名称与警示标志对应正确的是( )
| A. |  酒精 | B. |  浓硫酸 | C. |  汽油 | D. |  浓硝酸 |
10.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法错误的是( )


| A. | 该反应的热化学方程式为:N2(g)+O2(g)=2NO(g)△H=+180 kJ•mol-1 | |
| B. | 1 mol N2(l)和NA个 O2(l)反应生成2mol NO(g)时,吸收的能量为180 kJ | |
| C. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 | |
| D. | 通常情况下,N2(g)和O2(g)混合不能直接生成NO(g) |
17.关于如图装置的说法正确的是( )
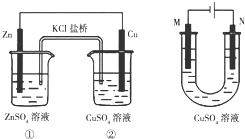

| A. | 装置①将电能转变为化学能 | |
| B. | 装置①中盐桥内的Cl-移向ZnSO4溶液 | |
| C. | 若装置②用于铁棒镀铜,则N极为铁棒 | |
| D. | 若装置②用于电解精炼铜,则溶液中的Cu2+浓度保持不变 |
4.粗盐中含有可溶性杂质CaCl2、MgCl2和Na2SO4,若要得到纯净的NaCl固体,有如下实验操作:
①蒸发结晶
②加入过量NaOH溶液
③加入过量BaCl2溶液
④加入过量Na2CO3溶液
⑤加入过量盐酸
⑥过滤.
正确的实验操作顺序是( )
①蒸发结晶
②加入过量NaOH溶液
③加入过量BaCl2溶液
④加入过量Na2CO3溶液
⑤加入过量盐酸
⑥过滤.
正确的实验操作顺序是( )
| A. | ②③④⑤⑥① | B. | ③④②⑤① | C. | ③②④⑥⑤① | D. | ④③⑥⑤① |
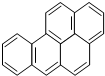 ,它是一种稠环芳香烃,其化学式为C20H12,此物质中碳元素和氢元素的质量比为20:1.
,它是一种稠环芳香烃,其化学式为C20H12,此物质中碳元素和氢元素的质量比为20:1.