题目内容
下列离子方程式中,正确的是( )
| A、酸性KMnO4溶液与双氧水反应:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O |
| B、NH4HSO3溶于过量NaOH溶液中:HSO3-+OH-=SO32-+H2O |
| C、向氯化银悬浊液中滴入饱和碘化钾溶液:Ag++I-=AgI↓ |
| D、标准状况下672mL Cl2通入100mL0.1 mol?L-1FeBr2溶液中:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
考点:离子方程式的书写
专题:离子反应专题
分析:A.双氧水能还原酸性KMnO4溶液,使之褪色;
B.酸式盐和碱反应量少的全部反应;
C.发生沉淀的转化;
D.672mL Cl2的物质的量是0.03mol与0.01molFeBr2溶液完全反应.
B.酸式盐和碱反应量少的全部反应;
C.发生沉淀的转化;
D.672mL Cl2的物质的量是0.03mol与0.01molFeBr2溶液完全反应.
解答:
解:A.双氧水能还原酸性KMnO4溶液,使之褪色:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,故A正确;
B.NH4HSO3溶液与足量NaOH溶液也混合:NH4++HSO3-+2OH-═SO32-+H2O+NH3?H2O,故B错误;
C.向AgCl悬浊液中加入KI溶液的离子反应为AgCl+I-?AgI+Cl-,故C错误;
D.672mL Cl2的物质的量是0.03mol与0.01molFeBr2溶液完全反应:2Fe2++4Br-+6Cl2=2Fe3++2Br2+12Cl-,故D错误.
故选A.
B.NH4HSO3溶液与足量NaOH溶液也混合:NH4++HSO3-+2OH-═SO32-+H2O+NH3?H2O,故B错误;
C.向AgCl悬浊液中加入KI溶液的离子反应为AgCl+I-?AgI+Cl-,故C错误;
D.672mL Cl2的物质的量是0.03mol与0.01molFeBr2溶液完全反应:2Fe2++4Br-+6Cl2=2Fe3++2Br2+12Cl-,故D错误.
故选A.
点评:本题考查离子方程式的书写,题目难度中等,本题中注意把握物质的性质以及反应的过量问题,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列离子方程式正确的是( )
| A、Na2S2O3溶液中加入稀盐酸:2S2O32-+2H+=SO42-+3S↓+H2O |
| B、磁性氧化铁溶于稀硝酸:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O |
| C、100mL 0.1mol/L FeI2溶液与标况下0.224L Cl2:2Fe2++Cl2=2Fe3++2Cl- |
| D、向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -=2Al(OH)3↓+3BaSO4↓ |
NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A、T℃时,1L pH=6的纯水中,含有的OH-数目为l×10-8NA |
| B、一定条件下,2.3g的Na完全与O2反应生成 3.6g产物时失去的电子数为0.1NA |
| C、1.0L的0.1 mol?L-1Na2S溶液中含有的S2-离子数为0.1NA |
| D、标准状况下,22.4L的SO3中含有的SO3分子数为NA |
在常温下的Al2(SO4)3、K2SO4和H2SO4的混和溶液中,若pH=1,c(SO42-)=0.8mol/L,c(Al3+)=0.4mol/L,则K+的物质的浓度为( )
| A、0.1 mol/L |
| B、0.2 mol/L |
| C、0.3 mol/L |
| D、0.4 mol/L |
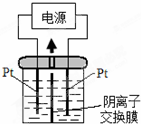 电解装置如图,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-=IO3-+5I-+3H2O,下列说法正确的是( )
电解装置如图,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-=IO3-+5I-+3H2O,下列说法正确的是( )| A、右侧发生的电极方程式:O2+4e-+2H2O=4OH- |
| B、电解槽内发生反应的总化学方程式是KI+3H2O=KIO3+3H2↑ |
| C、电解结束后,右侧溶液中不可能含有IO3- |
| D、如果用阳离子交换膜代替阴离子交换膜,电解槽内反应的总化学方程式不变 |




