题目内容
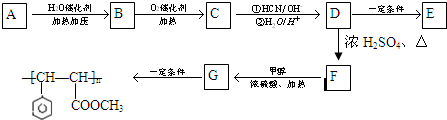
PM2.5(可入肺颗粒物)污染跟燃煤密切相关,燃煤还同时排放大量的SO2和NOX.旋转喷雾干燥法是去除燃煤烟气中二氧化硫的方法之一,工艺流程如图1所示:
(1)写出高速旋转雾化器中发生反应的化学方程式 .
(2)500℃时,在催化剂存在条件下,分别将2mol SO2和1mol O2置于恒压容器I和恒容容器Ⅱ中(两容器起始容积均为2L),充分反应,二者均达到平衡后:
①两容器中SO3的体积分数关系是I Ⅱ(填“>”、“<”或“=”).若平衡时测得容器II中的压强减小了30%,则该条件下的平衡常数K= .
②t1时刻分别向两容器的平衡体系中加入2mol SO3,则两容器中SO3的体积分数随时间变化曲线图图2正确的是 (填序号).

(1)写出高速旋转雾化器中发生反应的化学方程式
(2)500℃时,在催化剂存在条件下,分别将2mol SO2和1mol O2置于恒压容器I和恒容容器Ⅱ中(两容器起始容积均为2L),充分反应,二者均达到平衡后:
①两容器中SO3的体积分数关系是I
②t1时刻分别向两容器的平衡体系中加入2mol SO3,则两容器中SO3的体积分数随时间变化曲线图图2正确的是

考点:化学平衡的计算,化学平衡建立的过程
专题:
分析:(1)高速旋转雾化器中涉及反应为二氧化硫、氧气和氢氧化钙反应生成硫酸钙;
(2)①根据压强对化学平衡移动的影响知识来回答,反应体系中,压强之比等于物质的量之比,根据三段式计算平衡浓度;
②根据压强对速率和平衡影响分析,恒压容器I和恒容容器Ⅱ中,分别向两容器的平衡体系中加入2mol SO3,平衡逆向进行,气体的物质的量增大,恒压容器I的体积增大,恒容容器Ⅱ的体积不变压强增大,则容器Ⅱ的反应速率快达到平衡所用时间短,压强大平衡向生成SO3向进行,则容器Ⅱ中SO3含量高.
(2)①根据压强对化学平衡移动的影响知识来回答,反应体系中,压强之比等于物质的量之比,根据三段式计算平衡浓度;
②根据压强对速率和平衡影响分析,恒压容器I和恒容容器Ⅱ中,分别向两容器的平衡体系中加入2mol SO3,平衡逆向进行,气体的物质的量增大,恒压容器I的体积增大,恒容容器Ⅱ的体积不变压强增大,则容器Ⅱ的反应速率快达到平衡所用时间短,压强大平衡向生成SO3向进行,则容器Ⅱ中SO3含量高.
解答:
解:(1)高速旋转雾化器中涉及反应为二氧化硫、氧气和氢氧化钙反应生成硫酸钙,反应的方程式为2SO2+2Ca(OH)2+O2=2CaSO4+2H2O,
故答案为:2SO2+2Ca(OH)2+O2=2CaSO4+2H2O;
(3)①对于反应:2SO2(g)+O2(g)?2SO3(g),恒容容器相当于恒压容器的基础上加大压强,化学平衡正向移动,SO3的体积分数增大,所以Ⅰ>Ⅱ;
将2mol SO2和1mol O2置于恒容容器II中,设容器中O2的变化量为xmol,则x=3×30%=0.9,
2SO2(g)+O2(g)?2SO3(g)
初始物质的量:2 1 0
变化物质的量:1.8 0.9 1.8
平衡物质的量:0.2 0.1 1.8
平衡浓度(mol/L):0.1 0.05 0.9
K=
=1620;
故答案为:>;1620;
②恒压容器I和恒容容器Ⅱ中,分别向两容器的平衡体系中加入2mol SO3,平衡逆向进行,气体的物质的量增大,恒压容器I的体积增大,恒容容器Ⅱ的体积不变压强增大,则容器Ⅱ的反应速率快达到平衡所用时间短,压强大平衡向生成SO3向进行,则容器Ⅱ中SO3含量高,所以图A符合,
故答案为:A.
故答案为:2SO2+2Ca(OH)2+O2=2CaSO4+2H2O;
(3)①对于反应:2SO2(g)+O2(g)?2SO3(g),恒容容器相当于恒压容器的基础上加大压强,化学平衡正向移动,SO3的体积分数增大,所以Ⅰ>Ⅱ;
将2mol SO2和1mol O2置于恒容容器II中,设容器中O2的变化量为xmol,则x=3×30%=0.9,
2SO2(g)+O2(g)?2SO3(g)
初始物质的量:2 1 0
变化物质的量:1.8 0.9 1.8
平衡物质的量:0.2 0.1 1.8
平衡浓度(mol/L):0.1 0.05 0.9
K=
| 0.92 |
| 0.12×0.05 |
故答案为:>;1620;
②恒压容器I和恒容容器Ⅱ中,分别向两容器的平衡体系中加入2mol SO3,平衡逆向进行,气体的物质的量增大,恒压容器I的体积增大,恒容容器Ⅱ的体积不变压强增大,则容器Ⅱ的反应速率快达到平衡所用时间短,压强大平衡向生成SO3向进行,则容器Ⅱ中SO3含量高,所以图A符合,
故答案为:A.
点评:本题涉及化学方程式的书写、化学平衡的计算、化学平衡移动的影响因素,侧重考查学生对数据的分析处理以及对知识的综合应用,题目综合性强,难度较大.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
 用如图所示装置处理含NO3-的酸性工业废水,某电极反应式为2NO3-+12H++10e-=N2+6H2O,则下列说法错误的( )
用如图所示装置处理含NO3-的酸性工业废水,某电极反应式为2NO3-+12H++10e-=N2+6H2O,则下列说法错误的( )| A、电源正极为A,电解过程中有气体放出 |
| B、电解时H+从质子交换膜左侧向右侧移动 |
| C、电解过程中,右侧电解液pH保持不变 |
| D、电解池一侧生成5.6g N2,另一侧溶液质量减少l8g |
34Se是人体必需微量元素.下列关于78Se和80Se的说法正确的是( )
| A、78Se和80Se互为同素异形体 |
| B、78Se和80Se互为同位素 |
| C、78Se和80Se分别含有34个中子和46个质子 |
| D、78Se和80Se的化学性质不同 |
目前海水提溴的最主要方法之一是空气吹出法工艺,其流程图如下:以下推断不合理的是( )


| A、热空气能吹出溴是利用溴易挥发的性质 |
| B、SO2吸收溴的反应方程式:SO2+2H2O+Br2→H2SO4+2HBr |
| C、流程中循环利用的物质有SO2、Br2、Cl2等多种 |
| D、没有采用直接蒸馏含溴海水得到单质溴的主要原因是为了节能 |
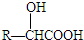

 水是极弱的电解质,改变温度或加入某些电解质会影响水的电离.请回答下列问题:
水是极弱的电解质,改变温度或加入某些电解质会影响水的电离.请回答下列问题: