题目内容
9.在某温度下,将H2(g) 和I2(g) 各0.10mol的气态混合物充入10L的密闭容器中,充分反应,达到平衡后,测得H2(g) 的浓度为0.0080mol•L-1.(1)求I2(g)+H2(g)?2HI(g)的平衡常数.
(2)在上述温度下,若向以上空容器中通入H2(g)和I2(g)各0.20mol,试求达到化学平衡状态时HI(g)的物质的量浓度和I2(g)转化为HI(g)的转化率.
分析 (1)在某温度下,将H2(g) 和I2(g) 各0.10mol的气态混合物充入10L的密闭容器中,达到平衡后,测得H2(g) 的浓度为0.0080mol•L-1,则:
I2(g)+H2(g)?2HI(g)
起始浓度(mol/L):0.010 0.010 0
变化浓度(mol/L):0.0020 0.0020 0.0040
平衡浓度(mol/L):0.0080 0.0080 0.0040
再根据K=$\frac{{c}^{2}(HI)}{c({I}_{2})×c({H}_{2})}$计算平衡常数;
(2)设达到平衡时I2(g)的浓度变化量为xmol/L,则:
I2(g)+H2(g)?2HI(g)
起始浓度(mol/L):0.02 0.02 0
变化浓度(mol/L):x x 2x
平衡浓度(mol/L):0.02-x 0.02-x 2x
再根据平衡常数列方程计算解答.
解答 解:(1)在某温度下,将H2(g) 和I2(g) 各0.10mol的气态混合物充入10L的密闭容器中,达到平衡后,测得H2(g) 的浓度为0.0080mol•L-1,则:
I2(g)+H2(g)?2HI(g)
起始浓度(mol/L):0.010 0.010 0
变化浓度(mol/L):0.0020 0.0020 0.0040
平衡浓度(mol/L):0.0080 0.0080 0.0040
平衡常数K=$\frac{{c}^{2}(HI)}{c({I}_{2})×c({H}_{2})}$=$\frac{0.00{4}^{2}}{0.008×0.008}$=0.25,
答:该温度下平衡常数为0.25.
(2)设达到平衡时I2(g)的浓度变化量为xmol/L,则:
I2(g)+H2(g)?2HI(g)
起始浓度(mol/L):0.02 0.02 0
变化浓度(mol/L):x x 2x
平衡浓度(mol/L):0.02-x 0.02-x 2x
所以$\frac{(2x)^{2}}{(0.02-x)×(0.02-x)}$=0.25,解得x=0.004,
所以 平衡时c(HI)=0.0080mol•L-1,
I2(g) 转化为HI(g)的转化率=$\frac{0.004mol/L}{0.02mol/L}$×100%=20%,
答:平衡状态时HI(g)的物质的量浓度为0.008mol/L,I2(g)转化为HI(g)的转化率为20%.
点评 本题考查化学平衡计算,涉及平衡常数计算及应用,(2)中可以利用等效平衡进行计算.

| A. | Ag+(aq)+Cl-(aq)═AgCl(s)△H=-51.1 kJ•mol-1 | |
| B. | 2K(s)+2H2O(l)═2K+(aq)+2OH-(aq)+H2(g)△H=-393.2 kJ•mol-1 | |
| C. | 2Mg(s)+O2(g)═2MgO(s)△H=-1203.2 kJ•mol-1 | |
| D. | CaCO3(s)═CaO(s)+CO2(g)△H=+178.2 kJ•mol-1 |
| A. | H+、CO32-、NO3- | B. | Cu2+、Cl-、OH- | C. | Na+、Cl-、HCO3- | D. | Ag+、K+、Cl- |
| A. | 原子核中有7个中子的碳原子:12C | |
| B. | 明矾的电离方程式是:KAl(SO4)2•12H2O═K++Al3++2SO42-+12H2O | |
| C. | K+结构示意图: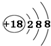 | |
| D. | Ba(OH)2与H2SO4反应的化学方程式是:Ba(OH)2+H2SO4═BaSO4↓+H2O |
| A. | 蔗糖 | B. | 一水合氨 | C. | 醋酸钠 | D. | 氨水 |
 工艺流程如图.
工艺流程如图.