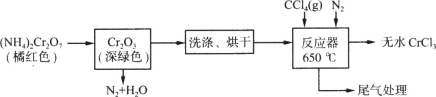
题目内容
下列说法正确的是:
A、向500mL 1 mol/LNa2CO3溶液中,滴加600mL 1 mol /LHCl 得到标况下CO2体积为2.24L
B、电解精炼铜时,若阴极得到2摩尔电子,则阳极质量减少64克
C、将208 g BaCl2固体溶解在1 L水中,形成的溶液的浓度为1 mol·L-1
D、可用pH试纸测得氯水的酸性强弱
A
【解析】
试题分析:向500mL 1 mol /LNa2CO3溶液中,滴加600mL 1 mol /LHCl,发生反应为:H++CO32—==HCO3—,H++ HCO3—==H2O+CO2,通过计算可得生成气体为0.1mol,体积为2.24L,故A项正确;电解精炼铜时,若阴极得到2摩尔电子,则阳极质量减少不一定是64g,因为阳极材料为粗铜,含杂质锌、铁、镍、银、金等,故B项错误;将208 g BaCl2固体溶解在1 L水中,溶液体积并不是1L,形成溶液的浓度不是1 mol·L-1,故C项错误;氯水中存在HclO,具有漂白性,能漂白指示剂,用PH试纸测氯水的酸性强弱最终试纸为白色,故D项错误。
考点:实验基本操作。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案【化学——选修3:物质结构与性质】(15分)
(1)含碳物质不完全燃烧会产生CO。血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒,写出铁离子(Fe3+)的核外电子排布式为 ,CO有多种等电子体,其中常见的一种分子是 。利用CO可以合成化工原料COCl2、配合物Fe(CO)5等,已知一个COCl2分子中每个原子最外层都形成8电子的稳定结构,则一个COCl2分子内含有 个δ键,C原子的杂化方式为 。Fe(CO)5等在一定条件下分解生成CO和铁,反应过程中断裂的化学键是 ,形成的化学键是 。
(2)A、B均为短周期金属元素。依据下表数据,回答问题:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
A | 932 | 1 821 | 15 390 | 21 771 |
B | 738 | 1 451 | 7 733 | 10 540 |
写出A原子的电子排布图 ,Al原子的第一电离能 (填:“大于”、“小于”或“等于”)738 kJ·mol-1,原因是 。
(3)下图是一种镍(Ni)镧(La)合金储氢后的晶胞结构图。该合金储氢后,含0.5mol Ni的合金可吸附氢气的体积(标况)为 。

将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
温度/℃ | 1.0 | 2.0 | 3.0 |
810 | 54.0 | a | b |
915 | c | 75.0 | d |
1000 | e | f | 83.0 |
下列说法错误的是:
A.b<f
B.915℃、2.0MPa时E的转化率为50%
C.该反应的△S>0
D.K(1000℃)>K(810℃)
下列有关化学用语表示正确的是
A.氯离子的结构示意图: |
| B.明矾的化学式:KAl(SO4)2 |
C.中子数为8的氧原子: |
D.溴化铵的电子式: |
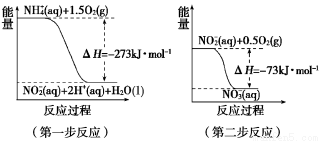

 压强/MPa
压强/MPa 体积分数/%
体积分数/%