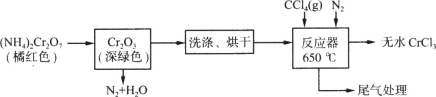
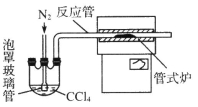
题目内容
用NA表示阿伏加德罗常数的数值,下列说法正确的是
A.0.1mol的白磷(P4)或四氯化碳(CCl4)中所含的共价键数均为0.4NA
B.1L 1mol/L的氯化铁溶液中,若Fe3+的数目为NA,则Cl—的数目为3NA
C.0.1 molN2和0.3molH2在一定条件下充分反应,转移电子数目为0.6NA
D.常温常压下,65gZn与足量浓 H2SO4充分反应,转移电子数一定为2NA
D
【解析】
试题分析:A、0.1mol的白磷(P4)所含的共价键数均为0.6NA ,A错误;B、Fe3+会水解,导致Fe3+的数目小于NA,B错误;C.该反应为可逆反应,不能彻底进行,C错误;D.Zn为1mol,根据化学方程式:Zn+H2SO4=ZnSO4+H2↑,硫酸过量,转移电子数2NA ,D正确;选D。
考点:考查阿伏伽德罗常数的应用。

练习册系列答案
相关题目
下列化学用语描述中正确的是
A.含18个中子的氯原子的核素符号: |
B.比例模型 可以表示CO2分子或SiO2分子 可以表示CO2分子或SiO2分子 |
C.HCO3-的电离方程式为:HCO3-+ H2O CO32-+H3O+ CO32-+H3O+ |
| D.次氯酸的结构式:H-Cl-O |
下列有关化学用语表示正确的是
A.氯离子的结构示意图: |
| B.明矾的化学式:KAl(SO4)2 |
C.中子数为8的氧原子: |
D.溴化铵的电子式: |
下列对于“摩尔”的理解正确的是( )
| A.摩尔是国际科学界建议采用的一种物理量 |
| B.摩尔是物质的量的单位,简称摩,符号为mol |
| C.摩尔可以把物质的宏观数量与微观粒子的数量联系起来 |
| D.国际上规定,0.012kg碳原子所含有的碳原子数目为1摩 |

 I2+I–
I2+I–