题目内容
15.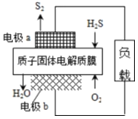 科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫.质子膜H2S燃料电池的结构示意图如图所示.下列说法不正确的是( )
科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫.质子膜H2S燃料电池的结构示意图如图所示.下列说法不正确的是( )| A. | 电极a为电池的负极 | |
| B. | 电极b上发生的电极反应为:O2+4H++4e-═2H2O | |
| C. | 电路中每流过4 mol电子,在正极消耗44.8LH2S | |
| D. | 每17 g H2S参与反应,有1 mol H+经质子膜进入正极区 |
分析 根据2H2S(g)+O2(g)═S2(s)+2H2O反应,得出负极H2S失电子发生氧化反应,正极O2得电子发生还原反应,以此解答该题.
解答 解:A.a极上硫化氢失电子生成S2和氢离子,发生氧化反应,则a为负极,故A正确;
B.正极O2得电子发生还原反应,酸性条件下,氧气得电子生成水,则电极b上发生的电极反应为:O2+4H++4e-=2H2O,故B正确;
C.气体存在的条件未知,不能确定体积大小,故C错误;
D.每17g即0.5molH2S参与反应,则消耗0.25mol氧气,则根据O2+4H++4e-=2H2O,所以有1mol H+经质子膜进入正极区,故D正确.
故选C.
点评 本题考查原电池原理,为高频考点,侧重考查学生的分析能力,注意把握原电池工作原理,结合氧化还原反应从化合价变化的角度分析,明确电解质溶液酸碱性是解本题关键,难点是电极反应式的书写,题目难度不大.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案
相关题目
5.某实验小组的同学用0.5mol/L的NaOH溶液与0.5mol/L的H2SO4溶液进行中和热 的测定实验及中和滴定实验.
I.配制溶液(以NaOH溶液为例)
(1)实验需要0.5mol/L NaOH溶液245mL,则至少需要NaOH固体5.0g.
(2)配制NaOH溶液过程中,一定需要下列仪器中的填写仪器的标号)如图21
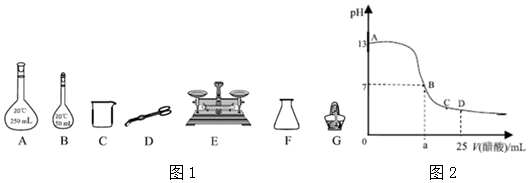
II.测定NaOH溶液与稀 H2SO4反应的中和热 取50mLNaOH溶液与30mL H2SO4溶液进行实验,测得数据如表:
(3)如果将0.5mol/LNaOH溶液和0.5mol/LH2SO4溶液的密度都看成1g/cm3,中和后生成的溶液的比热容c=4.18J•g-1•℃-1.则中和热△H=-52.8KJ/mol.
(4)上述实验计算结果与一57.3kJ/mol存在偏差的原因可能是ACD(填序号)
A.实验装置保温、隔热效果差
B量取NaOH溶液体积时仰视读数
C.分多次将NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后,直接测定H2S04溶液的温度
III.向25mLNaOH溶液中逐滴加入0.2mol/LCH3COOH溶液,滴定曲线如图所示:
(5)写出NaOH溶液与CH3COOH溶液反应的离子方程式CH3COOH+OH-=CH3COO-+H2O.
(6)该NaOH溶液的物质的量浓度为0.1mol/L.
(7)当滴加CH3COOH溶液至D点时,所得混合溶 液中各离子浓度的大小为c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
I.配制溶液(以NaOH溶液为例)
(1)实验需要0.5mol/L NaOH溶液245mL,则至少需要NaOH固体5.0g.
(2)配制NaOH溶液过程中,一定需要下列仪器中的填写仪器的标号)如图21

II.测定NaOH溶液与稀 H2SO4反应的中和热 取50mLNaOH溶液与30mL H2SO4溶液进行实验,测得数据如表:
| 起始温度/℃ | 终止温度/℃ | 温度差/℃ | |||
| H2SO4溶液 | NaOH溶液 | 平均值 | |||
| 1 | 25.0 | 24.5 | 24.75 | 29.3 | 4.55 |
| 2 | 24.5 | 24.2 | 24.35 | 28.3 | 3.95 |
| 3 | 25.0 | 24.5 | 24.75 | 28.7 | 3.95 |
(4)上述实验计算结果与一57.3kJ/mol存在偏差的原因可能是ACD(填序号)
A.实验装置保温、隔热效果差
B量取NaOH溶液体积时仰视读数
C.分多次将NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后,直接测定H2S04溶液的温度
III.向25mLNaOH溶液中逐滴加入0.2mol/LCH3COOH溶液,滴定曲线如图所示:
(5)写出NaOH溶液与CH3COOH溶液反应的离子方程式CH3COOH+OH-=CH3COO-+H2O.
(6)该NaOH溶液的物质的量浓度为0.1mol/L.
(7)当滴加CH3COOH溶液至D点时,所得混合溶 液中各离子浓度的大小为c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
6.下列说法或表示方法中正确的是( )
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ/mol | |
| D. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,浓H2SO4与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ/mol |
3.下列有关实验操作、现象及结论的叙述正确的是( )
| A. | 用钠可以检验某无水酒精中是否含有水 | |
| B. | 140℃时,无水乙醇与浓硫酸共热可制备乙烯 | |
| C. | 制取乙酸乙酯时,试剂加入的顺序是:先加入乙醇,后慢慢加入浓硫酸,最后加入乙酸 | |
| D. | 在蔗糖溶液中加入少量稀硫酸,水浴加热后,再加入少量新制的氢氧化铜悬浊液,加热至沸腾,没有砖红色沉淀生成,说明蔗糖没有水解 |
7.下列有关有机化合物的说法正确的是( )
| A. | 苯与液溴FeBr3作催化剂的条件下发生取代反应,生成溴苯 | |
| B. | 分子式为C5H10Q2,且能与NaHCO3反应的有机物有3种 | |
| C. | 乙醇制备乙烯和乙醇制备乙酸乙酯均为取代反应 | |
| D. | 2-甲基戊烷和4-甲基戊烷互为同分异构体 |
16.下列关于有机物的说法正确的是( )
| A. | 制备CH3CHCl2:乙烷在光照条件下和氯气反应或乙烯和氯水反应 | |
| B. | 沸点和在水中的溶解度:乙醇大于乙烷 | |
| C. | 鉴别溴苯和CCl4:硝酸银溶液 | |
| D. | 除去乙酸乙酯中混有的乙酸和乙醇:NaOH溶液 |
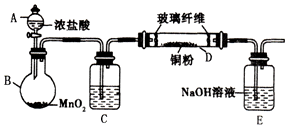 实验室采用如图所示的装置制取氯化铜(部分仪器和夹持装置已略去).
实验室采用如图所示的装置制取氯化铜(部分仪器和夹持装置已略去).
 ;②步骤2的离子方程式为12Ag++2H3As+3H2O═12Ag↓+As2O3+12H+;
;②步骤2的离子方程式为12Ag++2H3As+3H2O═12Ag↓+As2O3+12H+;


