题目内容
15.用两支惰性电极插入500mLAgNO3溶液中,通电电解.当电解液的pH从6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),电极上析出银的质量大约是( )| A. | 27mg | B. | 54mg | C. | 108mg | D. | 216mg |
分析 根据电池反应式找出硝酸与银的关系式,根据关系式用硝酸的物质的量计算银的质量.
解答 解:当电解液的pH值从6.0变为3.0时,氢离子的浓度由10-6mol/L变为10-3mol/L,一个硝酸分子中含一个氢原子,所以硝酸的浓度等于氢离子的浓度.
设生成银xg.该电池反应式为:
4AgNO3+2 H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4 HNO3
(4×108)g 4mol
xg (10-3mol/L-10-6mol/L)×0.5L
所以x=0.054
0.054g=54mg,
故选:B.
点评 本题以电解原理为载体考查了氧化还原反应的有关计算,解题时要明确硝酸是强酸,在水溶液中完全电离,水电离出的氢离子相对于硝酸电离出的较小,所以忽略不计,即溶液中的氢离子浓度近似等于硝酸的浓度,然后再根据硝酸与金属的关系计算即可.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
5.一定温度下,在容积为3L的密闭容器内发生反应CO(g)+H2O(g)?H2(g)+CO2(g)△H<0,起始时充入1mol CO和1mol H2O(g),2min后反应达到平衡状态,此时CO2的浓度为0.2mol•L-1,下列说法正确的是( )
| A. | 达到平衡时CO2的体积分数为20% | |
| B. | 降低温度,正反应速率减小程度比逆反应速率减小程度大 | |
| C. | 加入催化剂,改变了反应的途径,反应的△H也随之改变 | |
| D. | 在达平衡的过程中,任意时刻CO和H2O的转化率都相同 |
6.X、Y、Z、W、Q都是短周期元素,其中X原子的最外层电子数是内层电子数的3倍;X与Z同族,Y与Z同周期,Q原子的电子总数等于其电子层数的3倍,W与X、Y既不同族也不同周期且W不为稀有气体元素;X、Y、Z三种元素的族序数之和为16.下列说法正确的是( )
| A. | Q与W能形成10电子,不能形成14电子、18电子分子 | |
| B. | Y的最高价氧化物对应水化物的化学式只能表示为H4YO4 | |
| C. | Y、Z、Q分别与X化合,只能形成AB2型化合物 | |
| D. | X、Z、W三种元素形成的两种钠盐溶液发生化学反应生成的气体可使品红溶液褪色 |
3.对某弱酸稀溶液加热时,下列叙述错误的是( )
| A. | 弱酸的电离程度增大 | B. | 弱酸分子的浓度减小 | ||
| C. | 溶液的c(OH-)增大 | D. | 溶液的导电性增强 |
10.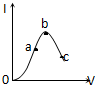 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示,下列叙述正确的是( )
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示,下列叙述正确的是( )
 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示,下列叙述正确的是( )
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示,下列叙述正确的是( )| A. | a、b、c三点处,溶液c(H+)由小到大的顺序为a、b、c | |
| B. | a、b、c三点处,电离程度最大的是b | |
| C. | a、b、c三点处,c(CH3COO-)最大的是c | |
| D. | 若使c点溶液中c(CH3COO-)增大,可采取的措施有加入NaOH固体或加热 |
20.下列表示化学反应的离子方程式,其中正确的是:( )
| A. | NH4HSO3溶液与足量NaOH溶液共热:NH4++HSO3-+2OH- $\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+SO32-+2H2O | |
| B. | 向氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 大理石溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液Fe2++2H++H2O2═Fe3++2H2O |
7.下列有关实验的做法错误的是( )
| A. | 分液时,分液漏斗中的上层液体应由上口倒出 | |
| B. | 用NaOH固体配制100mL 1mol•L-1的氢氧化钠溶液时,用到的玻璃仪器主要有玻璃棒、烧杯、量筒、胶头滴管、100mL容量瓶 | |
| C. | 配制一定物质的量浓度溶液过程中,玻璃棒的作用主要是搅拌和引流 | |
| D. | 容量瓶在使用前要检查是否漏水,若瓶内残留蒸馏水会导致所得溶液浓度偏低 |
4.下列单体中,能在一定条件下发生加聚反应生成 的是( )
的是( )
 的是( )
的是( )| A. |  | B. |  | C. | 乙烯和 | D. |  |
5.下列变化中,需要加入还原剂才能实现的是( )
| A. | Cl-→Cl2 | B. | H2→H+ | C. | CuO→Cu | D. | Zn→Zn2+ |