题目内容
20. 我国科学家成功研发了甲烷和二氧化碳的共转化技术,利用分子筛催化剂高效制得乙酸,下列有关说法正确的是( )
我国科学家成功研发了甲烷和二氧化碳的共转化技术,利用分子筛催化剂高效制得乙酸,下列有关说法正确的是( )| A. | 消耗22.4 LCO2可制得1mol乙酸 | |
| B. | 该反应过程符合“绿色化学”原理,其原子利用率为100% | |
| C. | 该反应属于取代反应 | |
| D. | 反应物和生成物中均含有极性键和非极性键 |
分析 A.气体存在的条件未知,不能确定物质的量;
B.反应物全部转化为生成物;
C.甲烷和二氧化碳制得乙酸,方程式为:CO2+CH4→C2H4O2,属于化合反应;
D.甲烷和二氧化碳中含有C-H、C=O键.
解答 解:A.未注明是否标准状况,气体的摩尔体积不知,无法计算,故A错误;
B.该反应为化合反应,反应物全部转化为生成物,原子利用率达100%,符合“绿色化学”原理,故B正确;
C.甲烷和二氧化碳制得乙酸,方程式为:CO2+CH4→C2H4O2,属于化合反应,只有一种产物,不是取代反应,故C错误;
D.甲烷只含有C-H极性键,二氧化碳中只含有C=O极性键,没有非极性键,故D错误.
故选B.
点评 本题考查较为综合,涉及有机物的结构和性质,共价键等知识,为高频考点,侧重基础知识的考查,难度不大,注意把握绿色化学的特点.

练习册系列答案
相关题目
8.等物质的量的主族金属A、B、C分别与足量的稀盐酸反应,所得氢气的体积依次为VA、VB、VC,已知2VB═VC,且VA═VB+VC,则在C的生成物中,该金属元素的化合价是( )
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
15.下列说法正确的是( )
| A. | 100mL、pH=3的HA和HB分别与足量的锌充分反应,HA放出的氢气多,说明HA的酸性比HB强 | |
| B. | 电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 | |
| C. | 在NH4HSO4溶液中由于的水解促进了水的电离,所以水的电离程度增大 | |
| D. | 在一密闭容器中发生2SO2+O2?2SO3反应,增大压强,平衡会正向移动,$\frac{{{c}^{2}(SO}_{3})}{{{{c}^{2}(SO}_{2})c(O}_{2})}$的值增大 |
12.下列物质不能通过化合反应得到的是( )
| A. | H2SiO3 | B. | Fe(OH)3 | C. | FeCl2 | D. | Fe3O4 |
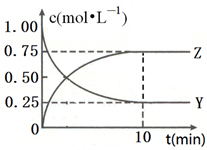 已知:2X(g)+Y(g)?a Z(g),在T1温度时,在体积为2L的密闭容器中,充入6mol X和2mol Y.根据图示回答:
已知:2X(g)+Y(g)?a Z(g),在T1温度时,在体积为2L的密闭容器中,充入6mol X和2mol Y.根据图示回答: 现有反应:A CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
现有反应:A CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
 图为电解氯化铜溶液的装置
图为电解氯化铜溶液的装置