题目内容
11.用有阳离子交换膜(只允许阳离子通过)的电解槽电解食盐水时,以下叙述错误的是( )| A. | 用铁作阴极 | B. | 用碳棒作正极 | ||
| C. | 食盐水从阳极区加入 | D. | 烧碱溶液从阴极区流出 |
分析 用有阳离子交换膜(只允许阳离子通过)的电解槽电解食盐水时,
A.Fe作阴极,阴极上氢离子放电生成氢气;
B.电解池电极为阴阳极,原电池电极为正负极;
C.阳极上氯离子放电生成氯气;
D.阴极上氢离子放电生成氢气,同时阴极附近有氢氧根离子生成.
解答 解:用有阳离子交换膜(只允许阳离子通过)的电解槽电解食盐水时,
A.Fe作阴极,阴极上氢离子放电生成氢气,同时阴极附近有氢氧化钠生成,所以铁电极不发生反应,故A正确;
B.电解池电极为阴阳极,原电池电极为正负极,所以石墨作阳极而不是正极,故B错误;
C.阳极上氯离子放电生成氯气,所以阳极区域应该加入含有氯离子的电解质溶液,加入氯化钠溶液即可,故C正确;
D.阴极上氢离子放电生成氢气,同时阴极附近有NaOH生成,所以烧碱溶液从阴极区流出,故D正确;
故选B.
点评 本题考查电解原理,为高频考点,明确各个电极上发生的反应是解本题关键,难点是确定各个电极附近加入物质流出物质,题目难度不大.

练习册系列答案
相关题目
1. 原电池原理的发现和各式各样电池装置的发明是化学对人类的一项重大贡献.关于如图
原电池原理的发现和各式各样电池装置的发明是化学对人类的一项重大贡献.关于如图
所示原电池的说法正确的是( )
 原电池原理的发现和各式各样电池装置的发明是化学对人类的一项重大贡献.关于如图
原电池原理的发现和各式各样电池装置的发明是化学对人类的一项重大贡献.关于如图所示原电池的说法正确的是( )
| A. | 将电能转化为化学能的装置 | B. | 电子由铜片经导线流向锌片 | ||
| C. | 锌片为负极,发生氧化反应 | D. | 铜片上发生的反应为Cu2++2e-═Cu |
19.1-乙氧基萘常用作香料,也可合成其他香料.实验室制备1-乙氧基萘的过程如图1:

已知:1-萘酚的性质与苯酚相似,有难闻的苯酚气味.相关物质的物理常数:
(1)将72g 1-萘酚溶于100mL无水乙醇中,加入5mL浓硫酸混合.将混合液置于如图2所示的容器中加热充分反应.实验中使用过量乙醇的原因是提高1-萘酚的转化率.
(2)装置中长玻璃管的作用是:冷凝回流.
(3)该反应能否用实验室制备乙酸乙酯的装置不能(选填“能”或“不能”),简述理由产物沸点大大高于反应物乙醇,会降低产率.
(4)反应结束,将烧瓶中的液体倒入冷水中,经处理得到有机层.为提纯产物有以下四步操作:①蒸馏;②水洗并分液;③用10%的NaOH溶液碱洗并分液;④用无水氯化钙干燥并过滤.正确的顺序是a(选填编号).
a.③②④①b.①②③④c.②①③④
(5)实验测得1-乙氧基萘的产量与反应时间、温度的变化如图3所示,时间延长、温度升高,1-乙氧基萘的产量下降可能的两个原因是1-萘酚被氧化,温度高乙醇大量挥发或温度高发生副反应.
(6)提纯的产品经测定为43g,本实验中1-乙氧基萘的产率为50%.

已知:1-萘酚的性质与苯酚相似,有难闻的苯酚气味.相关物质的物理常数:
| 物质 | 相对分 子质量 | 状态 | 熔点(℃) | 沸点(℃) | 溶解度 | |
| 水 | 乙醇 | |||||
| 1-萘酚 | 144 | 无色或黄色菱形结晶或粉末 | 96℃ | 278℃ | 微溶于水 | 易溶于乙醇 |
| 1-乙氧基萘 | 172 | 无色液体 | 5.5℃ | 267℃ | 不溶于水 | 易溶于乙醇 |
| 乙醇 | 46 | 无色液体 | -114.1℃ | 78.5℃ | 任意比混溶 | |
(2)装置中长玻璃管的作用是:冷凝回流.
(3)该反应能否用实验室制备乙酸乙酯的装置不能(选填“能”或“不能”),简述理由产物沸点大大高于反应物乙醇,会降低产率.
(4)反应结束,将烧瓶中的液体倒入冷水中,经处理得到有机层.为提纯产物有以下四步操作:①蒸馏;②水洗并分液;③用10%的NaOH溶液碱洗并分液;④用无水氯化钙干燥并过滤.正确的顺序是a(选填编号).
a.③②④①b.①②③④c.②①③④
(5)实验测得1-乙氧基萘的产量与反应时间、温度的变化如图3所示,时间延长、温度升高,1-乙氧基萘的产量下降可能的两个原因是1-萘酚被氧化,温度高乙醇大量挥发或温度高发生副反应.
(6)提纯的产品经测定为43g,本实验中1-乙氧基萘的产率为50%.
6.科学家将石墨在氟磺酸中“溶解”制得石墨烯(即单层石墨),该溶解克服了石墨层与层之间的( )
| A. | 范德华力 | B. | 离子键 | C. | 共价键 | D. | 金属键 |
16.实验室用5%的NaOH溶液洗涤硝基苯以除去其中的酸性杂质,洗涤时不要用到( )
| A. | 漏斗 | B. | 分液漏斗 | C. | 烧杯 | D. | 滤纸 |
3.钛元素的外围电子排布为3d24s2. 实验室利用反应TiO2(s)+CCl4(g)$\stackrel{△}{→}$ TiCl4(g)+CO2(g)制取TiCl4,装置如下:
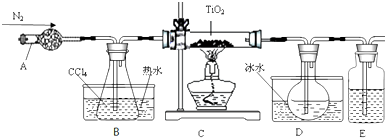
有关物质的性质如下表.
(1)装置E中的试剂是浓硫酸.反应结束前进行如下操作:
①停止通氮气 ②熄灭酒精灯 ③冷却至室温
正确的顺序为②③①(填序号).
(2)欲分离D中的液态混合物,所采用操作的名称是蒸馏.
(3)TiCl4 遇到湿空气发生强烈水解,其中一种物质是TiO(OH)2,试写出该水解反应的化学方程式TiCl4+3H2O=TiO(OH)2+4HCl.
(4)有同学认为该反应还会生成CO,所以要增加尾气吸收装置,试分析该观点的合理性不合理;因为不会发生氧化还原反应
(5)也可以用反应TiO2(s)+2C(s)+2Cl2(g) $\stackrel{△}{→}$TiCl4(g)+2CO(g) 制取TiCl4,在上述实验装置中将通氮气改为通氯气,撤去装置B,请简述对该装置的其它改变处石英管内改为盛TiO2和C;将E改为盛碱石灰的干燥管;增加CO的吸收装置(答橡胶袋、盛醋酸亚铜氨的洗气瓶等均可).

有关物质的性质如下表.
| 物质 | 熔点/℃ | 沸点/℃ | 其它 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
①停止通氮气 ②熄灭酒精灯 ③冷却至室温
正确的顺序为②③①(填序号).
(2)欲分离D中的液态混合物,所采用操作的名称是蒸馏.
(3)TiCl4 遇到湿空气发生强烈水解,其中一种物质是TiO(OH)2,试写出该水解反应的化学方程式TiCl4+3H2O=TiO(OH)2+4HCl.
(4)有同学认为该反应还会生成CO,所以要增加尾气吸收装置,试分析该观点的合理性不合理;因为不会发生氧化还原反应
(5)也可以用反应TiO2(s)+2C(s)+2Cl2(g) $\stackrel{△}{→}$TiCl4(g)+2CO(g) 制取TiCl4,在上述实验装置中将通氮气改为通氯气,撤去装置B,请简述对该装置的其它改变处石英管内改为盛TiO2和C;将E改为盛碱石灰的干燥管;增加CO的吸收装置(答橡胶袋、盛醋酸亚铜氨的洗气瓶等均可).
20.化学反应时,反应物的量不同,产物或现象可能会发生变化.下列正确的是( )
| A. | 硫在少量氧气中燃烧成SO2,过量能生成SO3 | |
| B. | 铁丝在少量氯气中燃烧生成FeCl2,过量则生成FeCl3 | |
| C. | 氯水滴入淀粉碘化钾稀溶液中,少量氯水有蓝色,过量蓝色消失 | |
| D. | NaClO溶液中通少量CO2生成Na2CO3和HClO,过量生成NaHCO3和HClO |
1.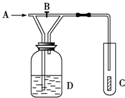 如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )
如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )
 如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )
如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )| A. | 浓H2SO4 | B. | NaOH溶液 | C. | H2O | D. | 饱和NaCl溶液 |
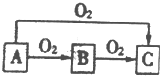 A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物)
A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物)