题目内容
在25℃时,在0.1mol/L NaX的溶液中,水电离出的OH-浓度为c1,在0.1mol?L-1的盐酸中,由水电离出的OH-浓度为c2,如果
=109,则0.1mol/L NaX的溶液的pH为( )
| c1 |
| c2 |
| A、4 | B、7 | C、10 | D、13 |
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:先计算出0.1mol?L-1的盐酸中水电离的氢氧根离子浓度,然后根据
=109计算出NaX溶液中氢氧根离子浓度,再根据水的离子积计算出溶液中氢离子浓度,最后根据pH=-lgc(H+)计算出NaX溶液的pH.
| c1 |
| c2 |
解答:
解:0.1mol?L-1的盐酸中的氢氧根离子为水电离的,则水电离的氢氧根离子浓度为:c(OH-)=c2=10-13mol/L,
=109,则c1=109×c2=10-13mol/L×109=10-4mol/L,
NaX溶液中氢氧根离子浓度等于水电离的氢氧根离子浓度,则NaX溶液中氢离子浓度为:c(H+)=
mol/L=10-10mol/L,该溶液的pH=10,
故选C.
| c1 |
| c2 |
NaX溶液中氢氧根离子浓度等于水电离的氢氧根离子浓度,则NaX溶液中氢离子浓度为:c(H+)=
| 10-14 |
| 10-4 |
故选C.
点评:本题考查了水的电离、溶液pH的计算方法,题目难度中等,注意掌握溶液酸碱性与溶液pH的计算方法,明确酸溶液中的氢氧根离子、碱溶液中的氢离子是水电离的是解答本题的关键.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
用NA表示阿伏加德罗常数,下列说法不正确的是( )
| A、2 mol SO2和1 mol O2 在一定条件下反应,反应后分子总数大于2NA |
| B、25℃时,在pH=2的1.0 L H2SO4溶液中含有H+数目为0.01NA |
| C、在二氧化硅的晶体中,1mol SiO2含有Si-O键数目为4NA |
| D、25mL 18 mol?L-1浓硫酸与足量Zn反应,转移电子数为0.225NA |
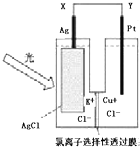 一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)═AgCl(s)=Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e--→Cl-(aq),若将光源移除,电池会立即回复至初始状态.下列说法正确的是( )
一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)═AgCl(s)=Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e--→Cl-(aq),若将光源移除,电池会立即回复至初始状态.下列说法正确的是( )| A、光照时,电流由Y流向X |
| B、光照时,Pt电极发生的反应为2Cl-+2e-═Cl2光 |
| C、光照时,Cl-向Ag电极移动 |
| D、光照时,电池总反应为:AgCl(s)+Cu+(aq)═Ag (s)+Cu2+(aq)+Cl-(aq) |
下列说法不正确的是( )
| A、所有的蛋白质、多糖及油脂均可以水解 |
| B、氢键在形成蛋白质的二级结构和DNA的双螺旋结构中起着关键作用 |
| C、光导纤维、玻璃纤维和光电池板的主要成份均是二氧化硅 |
| D、为了减缓月饼等富脂食品变质,可在包装内放入小包装的还原铁粉 |
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、常温下,1L0.1mol/L的NH4NO3溶液中氮原子数为0.2 NA |
| B、1mol羟基中电子数为10 NA |
| C、2.4g金属镁变为镁离子时失去的电子数为0.1NA |
| D、常温常压下乙烯中C-H键数为4NA |
如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )

| A、X和R在同一周期 |
| B、原子半径:W>R>X |
| C、气态氢化物的稳定性:Y>X |
| D、X、Z形成的化合物中不可能含有共价键 |
对下列有机反应类型的认识中,不正确的是( )
A、2CH3CH2OH+O2
| |||
B、CH3COOH+CH3CH2OH
| |||
C、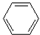 +HNO3 +HNO3
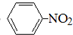 +H2O;取代反应 +H2O;取代反应 | |||
| D、CH2═CH2+Br2→CH2Br-CH2Br;加成反应 |
下列各条件下一定能共存的离子组是( )
| A、某无色溶液中:NH4+、Na+、Cl-、MnO4- |
| B、由水电离出的c(H+)═1×10-13mol?L-1的溶液中:Na+、K+、SO42-、HCO3- |
| C、在c(H+)═1×10-13mol?L-1的溶液中:Na+、AlO2-、SO42-、NO3- |
| D、在FeSO4的溶液中:K+、Na+、Cl-、NO3- |
 如图所示,烧杯内盛有浓HNO3,在烧杯中放入用导线相连的铁、铅两个电极,已知原电池停止工作时,Fe、Pb都有剩余.试依次写出Fe电极上可能发生的电极反应式.
如图所示,烧杯内盛有浓HNO3,在烧杯中放入用导线相连的铁、铅两个电极,已知原电池停止工作时,Fe、Pb都有剩余.试依次写出Fe电极上可能发生的电极反应式.