题目内容
6.某化学兴趣小组按如下实验流程提取海带中的碘,他们设计的 如图: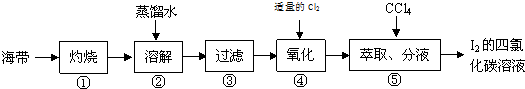
根据以上流程,回答以下问题.
(1)第①步是将海带放入坩埚(填仪器名称)中,用酒精灯充分加热灰化.
(2)第②步为了加快溶解速率并使碘离子充分进入溶液,可以采取的措施是充分搅拌、加热煮沸(写出两条).
(3)在第③步操作过程中,需要的玻璃仪器是玻璃杯、烧杯、漏斗.
(4)如第④步通入的Cl2是与NaI反应,发生反应的化学方程式为Cl2+2NaI=2NaCl+I2.
分析 (1)灼烧固体需要使用仪器坩埚;
(2)搅拌,加热,研磨能加快溶解速度;
(3)过滤中用到的玻璃仪器为玻璃杯、烧杯、漏斗;
(4)氯气氧化碘离子为碘单质.
解答 解:(1)灼烧固体需要使用仪器坩埚,故答案为:坩埚;
(2)搅拌,加热,研磨能加快溶解速度,故答案为:充分搅拌;加热煮沸;
(3)过滤中用到的玻璃仪器为玻璃杯、烧杯、漏斗,故答案为:玻璃杯、烧杯、漏斗;
(4)氯气氧化碘离子为碘单质,反应方程式为Cl2+2NaI=2NaCl+I2,故答案为:Cl2+2NaI=2NaCl+I2.
点评 本题考查海带成分中碘的检验,注意掌握萃取和分液的使用条件,掌握分析流程是解题关键,题目难度中等.

练习册系列答案
相关题目
8.下列说法中不正确的是( )
| A. | 含有离子键的化合物一定是离子化合物 | |
| B. | 非金属之间形成的化学键不一定是共价键 | |
| C. | 含有共价键的化合物不一定是共价化合物 | |
| D. | 在共价化合物中也可能含有离子键 |
9.下列有关有机化合物的认识正确的是( )
| A. | 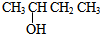 的名称为2-羟基丁烷 的名称为2-羟基丁烷 | |
| B. | 乙酸、乙酸乙酯和淀粉的最简式均为CH2O | |
| C. | (CH3)3CCH2C(CH3)=CH2的名称为 2,2,4-三甲基-1-戊烯 | |
| D. | 按系统命名法CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 |
6.下列变化需要加入氧化剂才能实现的是( )
| A. | NH${\;}_{4}^{+}$→NH3 | B. | S→S2- | C. | HCl→Cl2 | D. | CO32-→CO2 |
1.实验室从海带灰中提取碘的操作过程中,仪器选用不正确的是( )
| A. | 称取5 g左右的干海带--托盘天平 | |
| B. | 灼烧干海带至完全变成灰烬--坩埚 | |
| C. | 过滤煮沸后的海带灰和水的混合物--漏斗 | |
| D. | 用四氯化碳从氧化后的海带灰浸取液中提取碘--长颈漏斗 |
11. 高锰酸钾是一种重要的化学试剂,其溶液不是很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.
高锰酸钾是一种重要的化学试剂,其溶液不是很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.
(1)高锰酸钾溶液应配成中性溶液并保存在棕色试剂瓶中(填保存的注意事项).
(2)请配平高锰酸钾溶液与草酸钠Na2C2O4溶液在酸性条件下反应的离子方程式:
2MnO4-+5C2O42-+16H+--2Mn2++CO2↑+8H2O
(3)某学习小组为了探究高锰酸钾溶液和草酸钠溶液的反应过程,将高锰酸钾溶液逐滴地滴入一定体积的酸性草酸钠溶液中(温度相同,并不断振荡时),记录的现象如表:
请分析高锰酸钾溶液褪色时间变化的原因反应生成的Mn2+对反应有催化作用,且c(Mn2+)大催化效果更好.
(4)该学习小组在获取了上述经验和结论以后,用稳定的物质草酸钠Na2C2O4(相对分子质量134.0)来标定高锰酸钾溶液的浓度.他们准确称取1.340g纯净的草酸钠配成250mL溶液,每次准确量取25.00mL溶液酸化后用KMnO4溶液滴定.
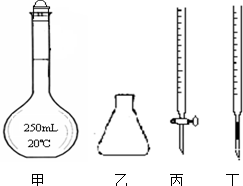
①高锰酸钾溶液应装在丙(填图中的仪器编号).
②若在实验过程中存在下列操作,其中会使所测KMnO4浓度偏低的是AC.
A.未润洗盛放KMnO4的滴定管 B.滴定前尖嘴部分无气泡,滴定终点时出现气泡
C.定容时,俯视刻度线 D.锥形瓶用水洗之后未用待测液润洗
③该滴定达到终点的标志为逐滴滴入高锰酸钾溶液,当滴入最后一滴高锰酸钾溶液时,溶液由无色变为紫红色,且半分钟内不褪色,最终消耗KMnO4溶液20.00mL(多次测定的平均值),则KMnO4溶液的浓度为0.0200mol/L(取4位有效数字).
 高锰酸钾是一种重要的化学试剂,其溶液不是很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.
高锰酸钾是一种重要的化学试剂,其溶液不是很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.(1)高锰酸钾溶液应配成中性溶液并保存在棕色试剂瓶中(填保存的注意事项).
(2)请配平高锰酸钾溶液与草酸钠Na2C2O4溶液在酸性条件下反应的离子方程式:
2MnO4-+5C2O42-+16H+--2Mn2++CO2↑+8H2O
(3)某学习小组为了探究高锰酸钾溶液和草酸钠溶液的反应过程,将高锰酸钾溶液逐滴地滴入一定体积的酸性草酸钠溶液中(温度相同,并不断振荡时),记录的现象如表:
| 滴入高锰酸钾溶液的次序(每滴溶液的体积相同) | 高锰酸钾溶液紫色褪去的时间 |
| 先滴入第1滴 | 1min |
| 褪色后再滴入第2滴 | 15s |
| 褪色后再滴入第3滴 | 3s |
| 褪色后再滴入第4滴 | 1s |
(4)该学习小组在获取了上述经验和结论以后,用稳定的物质草酸钠Na2C2O4(相对分子质量134.0)来标定高锰酸钾溶液的浓度.他们准确称取1.340g纯净的草酸钠配成250mL溶液,每次准确量取25.00mL溶液酸化后用KMnO4溶液滴定.
①高锰酸钾溶液应装在丙(填图中的仪器编号).
②若在实验过程中存在下列操作,其中会使所测KMnO4浓度偏低的是AC.
A.未润洗盛放KMnO4的滴定管 B.滴定前尖嘴部分无气泡,滴定终点时出现气泡
C.定容时,俯视刻度线 D.锥形瓶用水洗之后未用待测液润洗
③该滴定达到终点的标志为逐滴滴入高锰酸钾溶液,当滴入最后一滴高锰酸钾溶液时,溶液由无色变为紫红色,且半分钟内不褪色,最终消耗KMnO4溶液20.00mL(多次测定的平均值),则KMnO4溶液的浓度为0.0200mol/L(取4位有效数字).
18.已知:可逆反应N2(g)+3H2(g)?2NH3(g)△H<0.现有甲、乙两个容积相同且不变的真空密闭容器,向甲容器中加入1mol N2(g)和3mol H2(g),在一定条件下发生反应,达到平衡时放出热量为Q1kJ.在相同条件下,向乙容器中加入2mol NH3(g)并发生反应,达到平衡时吸收热量为Q2kJ,若Q1=3Q2.下列叙述中正确的是( )
| A. | Q1+Q2=92.4 | |
| B. | 达平衡时甲、乙中NH3的体积分数乙>甲 | |
| C. | 达到平衡后,再向乙中加入0.25mol N2(g)、0.75mol H2(g)和1.5mol NH3(g),平衡向生成N2的方向移动 | |
| D. | 达平衡时甲中N2的转化率为25% |
15.下列元素属于过度元素的是( )
| A. | 钾 | B. | 镓 | C. | 铁 | D. | 钋 |
16.下列措施肯定能使化学反应速率加快的是( )
| A. | 增加反应物的量 | B. | 增加压强 | C. | 升高温度 | D. | 缩小容器的体积 |