题目内容
把铜片和锌片放在盛有稀硫酸的表面皿(Ⅰ)中.把石墨a和石墨b放在盛有饱和食盐水的表面皿(Ⅱ)中.如下图所示.下列说法不正确的是( )
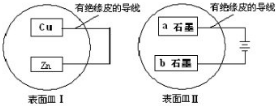

| A、表面皿Ⅰ和表面皿Ⅱ中溶液pH不断升高 |
| B、锌片和石墨a均发生氧化反应.铜片和石墨a上均有H2放出 |
| C、表面皿Ⅰ溶液中c(Zn2+)浓度增大 |
| D、石墨b附近滴加酚酞变红 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:I中Zn、Cu和稀硫酸构成原电池,Zn易失电子作负极、Cu作正极,负极反应式为Zn-2e-=Zn2+、正极反应式为2H++2e-=H2↑;II有外接电源,属于电解池,a为阳极、b为阴极,阳极电极反应式为2Cl--2e-=Cl2↑、阴极电极反应式为 2H2O+2e-=2OH-+H2↑,据此分析解答.
解答:
解:I中Zn、Cu和稀硫酸构成原电池,Zn易失电子作负极、Cu作正极,负极反应式为Zn-2e-=Zn2+、正极反应式为2H++2e-=H2↑;II有外接电源,属于电解池,a为阳极、b为阴极,阳极电极反应式为2Cl--2e-=Cl2↑、阴极电极反应式为 2H2O+2e-=2OH-+H2↑,
A.I中电池反应式为Zn+2H+=H2↑+Zn2+,氢离子参加反应导致溶液中氢离子浓度减小,则溶液的pH升高;
II中电池反应式为2H2O+2Cl-=Cl2↑+2OH-+H2↑,生成氢氧根离子导致溶液pH升高,故A正确;
B.I中Zn是负极,失电子发生氧化反应,II中石墨a是阳极,失电子发生氧化反应,铜片上生成氢气、石墨a上生成氯气,故B错误;
C.I中锌失电子生成锌离子,所以溶液中c(Zn2+)浓度增大,故C正确;
D.石墨b上电极反应式为2H2O+2e-=2OH-+H2↑,生成氢氧根离子,溶液呈碱性,则石墨b附近滴加酚酞变红,故D正确;
故选B.
A.I中电池反应式为Zn+2H+=H2↑+Zn2+,氢离子参加反应导致溶液中氢离子浓度减小,则溶液的pH升高;
II中电池反应式为2H2O+2Cl-=Cl2↑+2OH-+H2↑,生成氢氧根离子导致溶液pH升高,故A正确;
B.I中Zn是负极,失电子发生氧化反应,II中石墨a是阳极,失电子发生氧化反应,铜片上生成氢气、石墨a上生成氯气,故B错误;
C.I中锌失电子生成锌离子,所以溶液中c(Zn2+)浓度增大,故C正确;
D.石墨b上电极反应式为2H2O+2e-=2OH-+H2↑,生成氢氧根离子,溶液呈碱性,则石墨b附近滴加酚酞变红,故D正确;
故选B.
点评:本题考查原电池和电解池,侧重考查基本理论,明确各个电极上发生的反应是解本题关键,会正确书写电极反应式,题目难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
下列离子方程式中,正确的是( )
| A、稀硫酸滴在铁片上:2Fe+6H+═2Fe3++3H2↑ |
| B、碳酸氢钠溶液与稀盐酸混合:CO32-+2H+═H2O+CO2↑ |
| C、硫酸铜溶液与氢氧化钡混合:Cu2++2OH-═Cu(OH)2↓ |
| D、稀盐酸滴在石灰石上:CaCO3+2H+═H2O+CO2↑+Ca2+ |
下列有关实验的操作、原理和现象,不正确的是( )
| A、纸上层析法通常以滤纸作为惰性支持物.滤纸纤维上的羟基具有亲水性,它所吸附的水作固定相 |
| B、重结晶时,溶质的溶解度越大、溶液冷却速度越慢,得到的晶体颗粒越大 |
| C、往海带灰的浸泡液中加入过量的氯水,以保证I-完全氧化为I2 |
| D、将3~4个火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸和NaNO2溶液,若出现白色沉淀,说明含有氯元素 |
中草药秦皮中含有的七叶树内酯 (每个折点表示一个碳原子,氢原子未画出),具有抗菌作用.若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )
(每个折点表示一个碳原子,氢原子未画出),具有抗菌作用.若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )
 (每个折点表示一个碳原子,氢原子未画出),具有抗菌作用.若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )
(每个折点表示一个碳原子,氢原子未画出),具有抗菌作用.若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )| A、2molBr2 2molNaOH |
| B、2molBr2 3molNaOH |
| C、3molBr2 4molNaOH |
| D、4molBr2 4molNaOH |
 如图所示,某同学按照图装置进行如下实验,请回答下列问题:
如图所示,某同学按照图装置进行如下实验,请回答下列问题:


 分子中的亲水基是:
分子中的亲水基是:

 也能发生类似V→Ⅵ的反应,请写出所生成醇的结构简式
也能发生类似V→Ⅵ的反应,请写出所生成醇的结构简式