题目内容
某温度下,向一密闭的体积可变的容器中加入1molN2和3molH2,使之在一定条件下合成氨气.反应达到平衡后,测得平衡混合气体中氨气的浓度为m mol?L-1.若温度不变,只改变起始加入量,使之反应重新达到平衡,此时平衡气体中氨气的浓度仍为m mol?L-1,加入N2、H2、NH3的物质的量分别用Xmol、Ymol、Zmol表示,应满足:
(1)体积恒定时:若X=0,Y=0,则Z 压强恒定时:若X=0,Y=0,则Z
(2)体积恒定时:若X=0.65,Y ,Z 压强恒定时:若X=0.65,Y ,Z
(3)压强恒定时,X、Y、Z应满足的关系式为 .
(1)体积恒定时:若X=0,Y=0,则Z
(2)体积恒定时:若X=0.65,Y
(3)压强恒定时,X、Y、Z应满足的关系式为
考点:化学平衡的计算
专题:化学平衡专题
分析:温度不变,体积恒定时,两次平衡的氨气的浓度不变,为等效平衡,按化学计量数转化到左边满足n(N2)=1mol、n(H2)=3mol;
温度不变,压强恒定时,两次平衡的氨气的浓度不变,为等效平衡,按化学计量数转化到左边满足n(N2):n(H2)=1:3;
温度不变,压强恒定时,两次平衡的氨气的浓度不变,为等效平衡,按化学计量数转化到左边满足n(N2):n(H2)=1:3;
解答:
解:(1)温度不变,体积恒定时,两次平衡的氨气的浓度不变,为等效平衡,若X=0,Y=0,则Z=2时,按化学计量数转化到左边满足n(N2)=1mol、n(H2)=3mol,
温度不变,压强恒定时,两次平衡的氨气的浓度不变,为等效平衡,若X=0,Y=0,则Z为任意值时,按化学计量数转化到左边都满足n(N2):n(H2)=1:3,
故答案为:2;任意值;
(2)温度不变,体积恒定时,为完全等效平衡,按化学计量数转化到左边满足n(N2)=1mol、n(H2)=3mol,由N2(g)+3H2(g)?2NH3(g),则有:
,
解得Y=1.95,Z=0.7,
温度不变,压强恒定时,为等效平衡,按化学计量数转化到左边都满足n(N2):n(H2)=1:3,由N2(g)+3H2(g)?2NH3(g),则有:
(0.65+0.5Z):(Y+1.5Z)=1:3,
解得Y=1.95,Z为任意值,
故答案为:1.95;0.7;1.95;任意值;
(3)温度不变,压强恒定时,两次平衡的氨气的浓度不变,为等效平衡,按化学计量数转化到左边都满足n(N2):n(H2)=1:3,由N2(g)+3H2(g)?2NH3(g),则有:(X+0.5Z):(Y+1.5Z)=1:3,解得Y=3X,Z为任意值,且X、Y、Z不同时等于0,
故答案为:Y=3X,(X、Y、Z为非负数,且不同时等于0).
温度不变,压强恒定时,两次平衡的氨气的浓度不变,为等效平衡,若X=0,Y=0,则Z为任意值时,按化学计量数转化到左边都满足n(N2):n(H2)=1:3,
故答案为:2;任意值;
(2)温度不变,体积恒定时,为完全等效平衡,按化学计量数转化到左边满足n(N2)=1mol、n(H2)=3mol,由N2(g)+3H2(g)?2NH3(g),则有:
|
解得Y=1.95,Z=0.7,
温度不变,压强恒定时,为等效平衡,按化学计量数转化到左边都满足n(N2):n(H2)=1:3,由N2(g)+3H2(g)?2NH3(g),则有:
(0.65+0.5Z):(Y+1.5Z)=1:3,
解得Y=1.95,Z为任意值,
故答案为:1.95;0.7;1.95;任意值;
(3)温度不变,压强恒定时,两次平衡的氨气的浓度不变,为等效平衡,按化学计量数转化到左边都满足n(N2):n(H2)=1:3,由N2(g)+3H2(g)?2NH3(g),则有:(X+0.5Z):(Y+1.5Z)=1:3,解得Y=3X,Z为任意值,且X、Y、Z不同时等于0,
故答案为:Y=3X,(X、Y、Z为非负数,且不同时等于0).
点评:本题主要考查等效平衡,掌握恒温、恒容下前后气体体积不等的可逆反应等效平衡的条件时解题的关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法不正确的是( )
| A、胶体粒子的直径介于1~100 nm之间 |
| B、胶体和溶液都是混合物,它们属于不同的分散系 |
| C、胶体都是胶状粘稠的液体 |
| D、利用丁达尔效应可鉴别胶体和溶液 |
下列离子方程式中,正确的是( )
| A、在氯化铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓ |
| B、稀硫酸滴在铁片上:2Fe+6H+=2Fe3++3H2↑ |
| C、在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+ |
| D、过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
某温度下,Ksp (Mg(OH)2)=8.39×10-12,则Mg(OH)2的溶解度为( ) mol?L-1.
| A、2.05×10-4 |
| B、2.03×10-4 |
| C、1.28×10-4? |
| D、2.90×10-4 |
把铜片和锌片放在盛有稀硫酸的表面皿(Ⅰ)中.把石墨a和石墨b放在盛有饱和食盐水的表面皿(Ⅱ)中.如下图所示.下列说法不正确的是( )
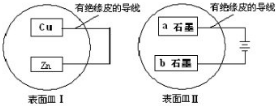

| A、表面皿Ⅰ和表面皿Ⅱ中溶液pH不断升高 |
| B、锌片和石墨a均发生氧化反应.铜片和石墨a上均有H2放出 |
| C、表面皿Ⅰ溶液中c(Zn2+)浓度增大 |
| D、石墨b附近滴加酚酞变红 |