题目内容
16. 分子中苯环上的一个氢被-C4H9原子团取代形成的有机物共有( )
分子中苯环上的一个氢被-C4H9原子团取代形成的有机物共有( )| A. | 12种 | B. | 10种 | C. | 9种 | D. | 6种 |
分析 -C4H9有四种结构,分别为:CH3-CH2-CH2-CH2-、CH3-CH2-CH(CH3)-、(CH3)2CH-CH2-、(CH3)3C-,苯环上两个取代基有邻间对三种结构.
解答 解:-C4H9有四种结构,分别为:CH3-CH2-CH2-CH2-、CH3-CH2-CH(CH3)-、(CH3)2CH-CH2-、(CH3)3C-,苯环上两个取代基有邻间对三种结构,共有4×3=12种.故选A.
点评 本题考查有机化合物的异构现象,注意根据-C4H9有四种结构,苯环上两个取代基有邻、间、对三种结构解题,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列物质中,不能使品红溶液褪色的是( )
| A. | 次氯酸 | B. | 活性炭 | C. | 二氧化碳 | D. | 二氧化硫 |
7.铝热反应原理可以应用在生产上,例如焊接钢轨、冶炼难熔金属、制作传统的烟火剂等.某小组同学在研究铝热反应时,进行如下讨论和实验.
(1)关于铝热反应有以下两种认识,其中正确的是b(填字母序号).
a.该反应需在高温下发生,所以是吸热反应
b.因为铝的还原性较强,所以铝能将相对不活泼的金属从其化合物中置换出来
(2)铝和氧化铁反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
(3)铝和氧化铁反应所得固体成分的初步确定.
①由上述实验可知:溶液中Fe元素的存在形式有Fe2+、Fe3+.
②i中产生H2的原因是样品中除含Fe外,可能有未反应的Al,为检验样品中是否含Al单质,可选用的试剂是
NaOH溶液,写出该反应的离子方程式2OH-+2Al+2H2O=2AlO2-+3H2↑.
③ii中生成O2的化学方程式是2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.
(1)关于铝热反应有以下两种认识,其中正确的是b(填字母序号).
a.该反应需在高温下发生,所以是吸热反应
b.因为铝的还原性较强,所以铝能将相对不活泼的金属从其化合物中置换出来
(2)铝和氧化铁反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
(3)铝和氧化铁反应所得固体成分的初步确定.
| 实验序号 | 操作现象 |
| i | 取少量固体样品,加入过量稀盐酸,固体溶解,产生气体(经检验为H2),溶液呈浅黄色 |
| ii | 向i所得溶液中加入少量KSCN溶液,溶液呈浅红色,再加入H2O2溶液,产生无色气体(经检验为O2,溶液变为深红色) |
②i中产生H2的原因是样品中除含Fe外,可能有未反应的Al,为检验样品中是否含Al单质,可选用的试剂是
NaOH溶液,写出该反应的离子方程式2OH-+2Al+2H2O=2AlO2-+3H2↑.
③ii中生成O2的化学方程式是2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.
4.下表是元素周期表的一部分,列出11种元素在周期表中的位置,填写下列空白
(1)这11种元素中化学性质最不活泼的是Ar,金属性最强的是K.(写元素符号)
(2)第三周期元素中,原子半径最大的元素是(稀有气体元素除外)Na,离子半径最小的是Al,单质氧化性最强的元素是Cl.(写元素符号)
(3)J的简单离子的结构示意图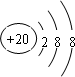 .
.
(4)D、E、F、K四元素的最高价氧化物对应水化物,按碱性依次减弱顺序排列为(写化学式)KOH>NaOH>Mg(OH)2>Al(OH)3.
(5)比较G、H两元素的最高价氧化物对应水化物的酸性HClO4>H2SO4.比较C、G两元素的气态氢化物稳定性HCl>H2S.(写化学式)
(6)C和D的单质在点燃条件下生成化合物的电子式为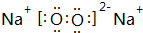 ,它属于离子(离子或共价)化合物.
,它属于离子(离子或共价)化合物.
(7)用电子式表示A和G所形成的简单化合物的形成过程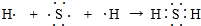 .
.
| 族 周期 | IA | IIA | IIIA | IV A | V A | VI A | VII A | O |
| 一 | A | |||||||
| 二 | B | C | ||||||
| 三 | D | E | F | G | H | I | ||
| 四 | K | J | ||||||
(2)第三周期元素中,原子半径最大的元素是(稀有气体元素除外)Na,离子半径最小的是Al,单质氧化性最强的元素是Cl.(写元素符号)
(3)J的简单离子的结构示意图
 .
.(4)D、E、F、K四元素的最高价氧化物对应水化物,按碱性依次减弱顺序排列为(写化学式)KOH>NaOH>Mg(OH)2>Al(OH)3.
(5)比较G、H两元素的最高价氧化物对应水化物的酸性HClO4>H2SO4.比较C、G两元素的气态氢化物稳定性HCl>H2S.(写化学式)
(6)C和D的单质在点燃条件下生成化合物的电子式为
 ,它属于离子(离子或共价)化合物.
,它属于离子(离子或共价)化合物.(7)用电子式表示A和G所形成的简单化合物的形成过程
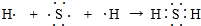 .
.
8.下列反应可用于设计原电池的是( )
| A. | CO2+2H2O→CH4+2O2 | B. | NaOH+HCl=NaCl+H2O | ||
| C. | Cu+2HCl=Cu Cl2+H2↑ | D. | 4Al+3O2+6H2O=4Al(OH)3 |
5.下列离子方程式书写正确的是( )
| A. | 硅与氢氧化钾溶液反应:Si+2OH-+H2O═SiO32-+2H2↑ | |
| B. | Al(OH)3溶于稀硝酸:OH-+H+═H2O | |
| C. | 往氨水中加入少量AlCl3溶液:Al3++4OH-═[Al(OH)4]- | |
| D. | 把水玻璃滴入盐酸中:SiO32-+2H+═H2SiO3 |
6.下列物质的性质比较,正确的是( )
| A. | 气态氢化物稳定性:HF>HCl | B. | 碱性:NaOH>KOH | ||
| C. | 非金属性:P>Cl | D. | 酸性:H2SO4>HClO4 |
 (部分试剂和反应条件已略去).
(部分试剂和反应条件已略去).
 .
.