题目内容
3. 已知X、Y、Z是三种原子序数依次增大的短周期元素.甲、乙、丙分别是三种元素形成的单质,A、B、C、D分别是由三种元素中的两种形成的化合物,且A与C中均含有10个电子.它们之间转化关系如图所示.下列说法正确的是( )
已知X、Y、Z是三种原子序数依次增大的短周期元素.甲、乙、丙分别是三种元素形成的单质,A、B、C、D分别是由三种元素中的两种形成的化合物,且A与C中均含有10个电子.它们之间转化关系如图所示.下列说法正确的是( )| A. | 原子半径:Z>Y>X | B. | 稳定性:A>C | ||
| C. | 反应②和③均为吸热反应 | D. | X、Y、Z可以形成离子化合物 |
分析 A与C中均含有10个电子,A燃烧可生成C,由转化关系可知A应为CH4,丙为O2,B为CO2,C为H2O,B、C都可与乙在高温下反应,乙应为C,则D为CO,甲为H2,则X为H元素,Y为C元素,Z为O元素,以此解答该题.
解答 解:由以上分析可知X为H元素,Y为C元素,Z为O元素,A为CH4,丙为O2,B为CO2,C为H2O,乙为C,D为CO,甲为H2,
A.同周期元素从左到右原子半径逐渐减小,应为C>O,故A错误;
B.非金属性O>C,元素的非金属性越强,对应的氢化物越稳定,故B错误;
C.反应②和③均为碳为还原剂的氧化还原反应,都为吸热反应,故C正确;
D.X为H元素,Y为C元素,Z为O元素,对应的化合物都为共价化合物,故D错误.
故选C.
点评 本题考查无机物的推断以及原子结构与元素周期律的综合应用,题目难度中等,A与C中均含有10个电子是推断突破口,再结合反应进行分析解答,对学生的逻辑推理有一定的要求,注意熟练掌握元素化合物知识,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
18.化学与生产、生活密切相关.下列有关叙述正确的是( )
| A. | 大气雾霾污染现象的产生与汽车尾气排放有关 | |
| B. | 玻璃和氮化硅陶瓷都属于新型无机非金属材料 | |
| C. | 活性炭与二氧化硫都可用于漂白,其漂白原理相同 | |
| D. | 空气中的臭氧对人体健康有益无害 |
14.下列热化学方程式书写正确的是( )
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1 367.0 kJ•mol-1(燃烧热) | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.3 kJ•mol-1(中和热) | |
| C. | S(s)+O2(g)═SO2(g)△H=-296.8 kJ•mol-1(反应热) | |
| D. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=+110.5 kJ•mol-1(燃烧热) |
18.元素是构成我们生活的世界中一切物质的“原材料”.
(1)自18世纪以来,科学家们不断探索元素之谜.通过从局部到系统的研究过程,逐渐发现了元素之间的内在联系.下面列出了几位杰出科学家的研究工作.
上述科学家的研究按照时间先后排序合理的是②③④①(填数字序号).
(2)1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,如图1所示.
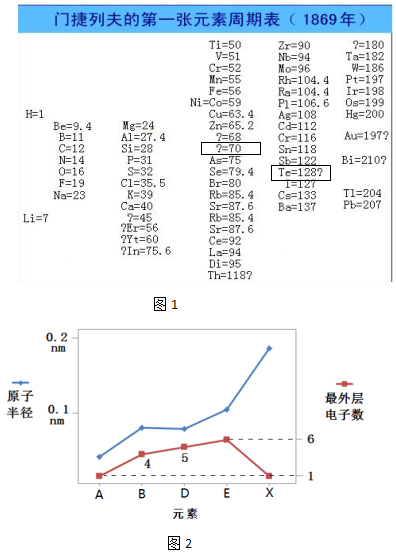
①门捷列夫将已有元素按照相对原子质量排序,同一横行(填“横行”或“纵列”)元素性质相似.结合表中信息,猜想第4列方框中“?=70”的问号表达的含义是相对原子质量为70的元素,第5列方框中“Te=128?”的问号表达的含义是怀疑Te的相对原子质量不是128.
②到20世纪初,门捷列夫周期表中为未知元素留下的空位逐渐被填满.而且,随着原子结构的逐渐揭秘,科学家们发现了元素性质不是随着相对原子质量递增呈现周期性变化,而是随着原子序数(核电荷数)递增呈现周期性变化.其本质原因是
A(填字母序号).
A.随着核电荷数递增,原子核外电子排布呈现周期性变化
B.随着核电荷数递增,原子半径呈现周期性变化
C.随着核电荷数递增,元素最高正化合价呈现周期性变化
(3)在现有的元素周期表中有A、B、D、E、X、Y、Z七种短周期元素.X与Y处于同一周期,Y的最高价氧化物的水化物与强酸、强碱均能反应.Z的单质常温下为气态,同条件下相对于氢气的密度比为35.5.其余信息如图2所示:
①上述七种元素中,处于第二周期的有C、N(用元素符号表示,下同),X在周期表中的位置是第三周期,第ⅠA族.
②E的原子结构示意图为 ,写出Z元素气态氢化物的电子式:
,写出Z元素气态氢化物的电子式: .
.
③B单质与E的最高价氧化物的水化物在一定条件下发生反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;Y单质与X的最高价氧化物的水化物溶液反应的离子方程式为2Al+2H2O+2OH-═2AlO2-+3H2↑.
④B和D的最高价氧化物的水化物的化学式分别为H2CO3、HNO3,二者酸性前者弱于(填“强于”或“弱于”)后者,原因是B和D的非金属性有差异,利用原子结构解释产生差异的原因:C原子和N原子具有相同电子层,N原子的核电荷数多于C,N原子半径小于C,N原子核对最外层电子的吸引作用大于C,故N非金属性强于C.
(1)自18世纪以来,科学家们不断探索元素之谜.通过从局部到系统的研究过程,逐渐发现了元素之间的内在联系.下面列出了几位杰出科学家的研究工作.
| 序号 | ① | ② | ③ | ④ |
| 科学家 | 纽兰兹 | 道尔顿 | 德贝莱纳 | 尚古尔多 |
| 工作 | 发现“八音律”,指出从某一指定的元素起,第八个元素是第一个元素的某种重复 | 创立 近代原子论,率先开始相对原子质量的测定工作 | 发现了5组性质相似的“三元素组”,中间元素的相对原子质量为前后两种元素相对原子质量的算术平均值 | 认为 各元素组之间并非毫不相关,可以用相对原子质量把它们按从小到大的顺序串联 |
(2)1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,如图1所示.

①门捷列夫将已有元素按照相对原子质量排序,同一横行(填“横行”或“纵列”)元素性质相似.结合表中信息,猜想第4列方框中“?=70”的问号表达的含义是相对原子质量为70的元素,第5列方框中“Te=128?”的问号表达的含义是怀疑Te的相对原子质量不是128.
②到20世纪初,门捷列夫周期表中为未知元素留下的空位逐渐被填满.而且,随着原子结构的逐渐揭秘,科学家们发现了元素性质不是随着相对原子质量递增呈现周期性变化,而是随着原子序数(核电荷数)递增呈现周期性变化.其本质原因是
A(填字母序号).
A.随着核电荷数递增,原子核外电子排布呈现周期性变化
B.随着核电荷数递增,原子半径呈现周期性变化
C.随着核电荷数递增,元素最高正化合价呈现周期性变化
(3)在现有的元素周期表中有A、B、D、E、X、Y、Z七种短周期元素.X与Y处于同一周期,Y的最高价氧化物的水化物与强酸、强碱均能反应.Z的单质常温下为气态,同条件下相对于氢气的密度比为35.5.其余信息如图2所示:
①上述七种元素中,处于第二周期的有C、N(用元素符号表示,下同),X在周期表中的位置是第三周期,第ⅠA族.
②E的原子结构示意图为
 ,写出Z元素气态氢化物的电子式:
,写出Z元素气态氢化物的电子式: .
.③B单质与E的最高价氧化物的水化物在一定条件下发生反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;Y单质与X的最高价氧化物的水化物溶液反应的离子方程式为2Al+2H2O+2OH-═2AlO2-+3H2↑.
④B和D的最高价氧化物的水化物的化学式分别为H2CO3、HNO3,二者酸性前者弱于(填“强于”或“弱于”)后者,原因是B和D的非金属性有差异,利用原子结构解释产生差异的原因:C原子和N原子具有相同电子层,N原子的核电荷数多于C,N原子半径小于C,N原子核对最外层电子的吸引作用大于C,故N非金属性强于C.
8.某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4•7H2O),设计了如图流程:下列说法不正确的是( )
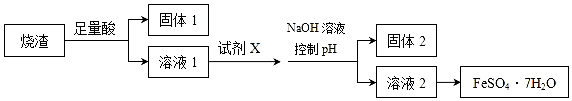

| A. | 溶液1中的阳离子可与NH4+、HCO3-、I-、SO42-在同一溶液中大量共存 | |
| B. | 向溶液2中加入3-5滴K3[Fe(CN)6](铁氰化钾)溶液,可观察到有蓝色沉淀生成 | |
| C. | 向固体2中加入足量NaOH溶液,发生反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O | |
| D. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解 |
15.工业上在一定条件下将丙烷脱氢制丙烯.
(1)反应过程中能量变化如图1所示,下列有关叙述正确的是ac.
a.此反应为吸热反应
b.催化剂能改变反应的焓变和活化能
c.E1表示正反应的活化能,E2表示逆反应的活化能
d.有催化剂能加快反应速率,提高丙烷的转化率
(2)上述反应在恒温恒容密闭容器中达到平衡,其平衡常数K的表达式为K=$\frac{c(C{H}_{2}=C{H}_{2})c({H}_{2})}{c(C{H}_{3}C{H}_{2}C{H}_{3})}$.若升温,该反应的平衡常数增大(填“增大”、“减小”或“不变”).若向上述反应达到平衡的容器内再通入少量丙烷,则$\frac{c(C{H}_{2}=CHC{H}_{3})}{c(C{H}_{3}C{H}_{2}C{H}_{3})}$减小(填“增大”、“减小”或“不变”).
(3)在0.1MPa、800K条件下,向恒容密闭容器中通入丙烷和稀有气体,丙烷脱氢反应的转化率随着稀有气体与丙烷比例的变化情况如图2所示,则随着稀有气体与丙烷比例的增加,丙烷转化率逐渐增大的原因是此反应是气体体积和增加的反应,随着稀有气体比例的增加,降低了反应体系各气体的分压,相当于减压,从而促进反应向正反应方向进行,提高了丙烷脱氢的转化率.

(4)上述反应生成物丙烯经多步氧化生成丙酸,已知常温下Ka(CH3CH2COOH)=1.3×10-5.Kb(NH3•H2O)=1.8×10-5.
①用离子方程式表示CH3CH2COONa溶液显碱性的原因CH3CH2COO-+H2O?CH3COOH+OH-.
②常温下,若丙酸与氨水混合后溶液呈中性,则溶液中$\frac{c(C{H}_{3}C{H}_{2}CO{O}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=1.3×109.
(5)已知:
则丙烷脱氢反应的热化学方程式为CH3CH2CH3(g)?CH2=CHCH3(g)+H2(g)△H=+126kJ/mol.
(1)反应过程中能量变化如图1所示,下列有关叙述正确的是ac.
a.此反应为吸热反应
b.催化剂能改变反应的焓变和活化能
c.E1表示正反应的活化能,E2表示逆反应的活化能
d.有催化剂能加快反应速率,提高丙烷的转化率
(2)上述反应在恒温恒容密闭容器中达到平衡,其平衡常数K的表达式为K=$\frac{c(C{H}_{2}=C{H}_{2})c({H}_{2})}{c(C{H}_{3}C{H}_{2}C{H}_{3})}$.若升温,该反应的平衡常数增大(填“增大”、“减小”或“不变”).若向上述反应达到平衡的容器内再通入少量丙烷,则$\frac{c(C{H}_{2}=CHC{H}_{3})}{c(C{H}_{3}C{H}_{2}C{H}_{3})}$减小(填“增大”、“减小”或“不变”).
(3)在0.1MPa、800K条件下,向恒容密闭容器中通入丙烷和稀有气体,丙烷脱氢反应的转化率随着稀有气体与丙烷比例的变化情况如图2所示,则随着稀有气体与丙烷比例的增加,丙烷转化率逐渐增大的原因是此反应是气体体积和增加的反应,随着稀有气体比例的增加,降低了反应体系各气体的分压,相当于减压,从而促进反应向正反应方向进行,提高了丙烷脱氢的转化率.

(4)上述反应生成物丙烯经多步氧化生成丙酸,已知常温下Ka(CH3CH2COOH)=1.3×10-5.Kb(NH3•H2O)=1.8×10-5.
①用离子方程式表示CH3CH2COONa溶液显碱性的原因CH3CH2COO-+H2O?CH3COOH+OH-.
②常温下,若丙酸与氨水混合后溶液呈中性,则溶液中$\frac{c(C{H}_{3}C{H}_{2}CO{O}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=1.3×109.
(5)已知:
| 化学键 | H-H | C-H | C-C | C=C |
| 键能(kJ•mol-1) | 436 | 413 | 348 | 612 |
12.硫可以形成分子式为S2、S4、S6、S8的单质,其中S8的分子结构如图所示.下列有关说法正确的是( )
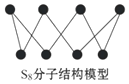

| A. | S2、S4、S6、S8互为同位素 | |
| B. | S2的摩尔质量为32 g/mol | |
| C. | 硫的单质在足量的空气中完全燃烧可生成SO3 | |
| D. | 1 mol S8单质中含有的S-S键个数为8NA |


 、
、 .
. +2 NaOH$→_{△}^{水}$
+2 NaOH$→_{△}^{水}$ +NaOH+H2O.
+NaOH+H2O. +2 Ag(NH3)2OH$\stackrel{△}{→}$
+2 Ag(NH3)2OH$\stackrel{△}{→}$ +2 Ag↓+3NH3+H2O.
+2 Ag↓+3NH3+H2O.
