题目内容
15.在光照条件下,Cl2与CH4反应生成CH3Cl是链式反应,主要反应机理如下:①Cl2(g)→Cl•(g)+Cl•(g)△H1=+243kJ•mol-1
②Cl•(g)+CH4(g)→CH3•(g)+HCl(g)△H2=+8.4kJ•mol-1
③CH3•(g)+Cl2(g)→CH3Cl(g)+Cl•(g)△H3=-111.8kJ•mol-1
下列有关说法正确的是( )
| A. | Cl•在反应中是催化剂 | |
| B. | Cl•比Cl2更活泼 | |
| C. | ②也可能是Cl•(g)+CH4(g)→CH3Cl(g)+H•(g) | |
| D. | 由③可知C-Cl的键能比Cl-Cl的键能小 |
分析 A、Cl•在反应中是反应物;
B、Cl•最外层7个电子,而Cl2中各原子达8电子的稳定结构;
C、Cl•使甲烷分子中的碳氢键断裂,形成活泼的氢与氯原子结合生成氯化氢;
D、共价键键长越长键能越小.
解答 解:A、Cl•在反应中是反应物,而不是催化剂,故A错误;
B、Cl•最外层7个电子,而Cl2中各原子达8电子的稳定结构,所以Cl•比Cl2更活泼,故B正确;
C、Cl•使甲烷分子中的碳氢键断裂,形成活泼的氢与氯原子结合生成氯化氢,所以不可能是Cl•(g)+CH4(g)→CH3Cl(g)+H•(g),故C错误;
D、碳的原子半径小于氯原子,所以键长C-Cl<Cl-Cl,则键能C-Cl的键能比Cl-Cl的键能大,故D错误;
故选B.
点评 本题考查了化学反应机理,难度不大,根据总反应方程式结合图片即可判断物质的性质、结构,侧重于考查学生的分析能力.

练习册系列答案
相关题目
10. 自然界中存在大量的金属元素,其 中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用.
自然界中存在大量的金属元素,其 中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用.
(1)请写出Fe的基态原子核外电子排布式1s22s22p63s23p63d64s2或[Ar]3d64s2.
(2)金属A的原子只有3个电子层,其第一至第四电离能如下:
则A原子的价电子排布式为3s2.
(3)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气体中的CO(Ac-代表CH3COO-),其反应是:[Cu(NH3)2]Ac+CO+NH3?[Cu(NH3)3CO]Ac[醋酸羰基三安合铜(I)]△H<0
①C、N、O三种元素的第一电离能由小到大的顺序为C<O<N;
②配合物[Cu(NH3)3CO]Ac中心原子的配位数为4;
③在一定条件下NH3与CO2能合成尿素[CO(NH2)2],尿素中C原子核N原子轨道的杂化类型分别为sp2、sp3;1mol尿素分子中,σ键的数目为7NA.
(4)NaCl和MgO都属于离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃.造成两种晶体熔点差距的主要原因是MgO晶体所含离子半径小,电荷数多,晶格能大.
(5)(NH4)2SO4、NH4NO3等颗粒物及扬尘等易引起雾霾.其中NH4-的空间构型是正四面体(用文字描述),与NO3-互为等电子体的分子是SO3或者BF3.(填化学式)
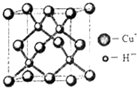
(6)铜的化合物种类很多,如图是氢化亚铜的晶胞结构,已知晶胞的棱长为acm,则氢化亚铜密度的计算式为ρ=$\frac{260}{{a}^{3}•{N}_{A}}$g/cm3.(用NA表示阿佛加德罗常数)
 自然界中存在大量的金属元素,其 中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用.
自然界中存在大量的金属元素,其 中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用.(1)请写出Fe的基态原子核外电子排布式1s22s22p63s23p63d64s2或[Ar]3d64s2.
(2)金属A的原子只有3个电子层,其第一至第四电离能如下:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
(3)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气体中的CO(Ac-代表CH3COO-),其反应是:[Cu(NH3)2]Ac+CO+NH3?[Cu(NH3)3CO]Ac[醋酸羰基三安合铜(I)]△H<0
①C、N、O三种元素的第一电离能由小到大的顺序为C<O<N;
②配合物[Cu(NH3)3CO]Ac中心原子的配位数为4;
③在一定条件下NH3与CO2能合成尿素[CO(NH2)2],尿素中C原子核N原子轨道的杂化类型分别为sp2、sp3;1mol尿素分子中,σ键的数目为7NA.
(4)NaCl和MgO都属于离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃.造成两种晶体熔点差距的主要原因是MgO晶体所含离子半径小,电荷数多,晶格能大.
(5)(NH4)2SO4、NH4NO3等颗粒物及扬尘等易引起雾霾.其中NH4-的空间构型是正四面体(用文字描述),与NO3-互为等电子体的分子是SO3或者BF3.(填化学式)
(6)铜的化合物种类很多,如图是氢化亚铜的晶胞结构,已知晶胞的棱长为acm,则氢化亚铜密度的计算式为ρ=$\frac{260}{{a}^{3}•{N}_{A}}$g/cm3.(用NA表示阿佛加德罗常数)
20.下列说法不正确的是( )
| A. | 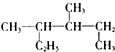 的系统命名是3,4-二甲基己烷 的系统命名是3,4-二甲基己烷 | |
| B. | 樱桃中含有一种羟基酸(如图所示)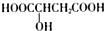 ,该羟基酸可以发生取代、氧化和缩聚等反应 ,该羟基酸可以发生取代、氧化和缩聚等反应 | |
| C. | 所有的糖、油脂、蛋白质都能水解,但水解产物不同 | |
| D. | 等质量的甲醛和乙酸充分燃烧耗氧量相同 |
7.下列物质的分子中既有σ键,又有π键的是( )
| A. | HCl | B. | H2O | C. | H2O2 | D. | C2H2 |
4.下表中的实验操作能达到实验目的是( )
| 选项 | 实验操作 | 实验目的 |
| A | 将浓硫酸和碳单质混合加热,直接将生成的气体通入足量的澄清石灰水,石灰水变浑浊 | 检验气体产物中CO2的存在 |
| B | 将NaOH的乙醇溶液加入溴乙烷中,加热,将产生的气体直接通入到酸性高锰酸钾溶液中,溶液褪色 | 证明溴乙烷的消去反应有乙烯生成 |
| C | 先滴入Ba(NO3)2溶液,产生沉淀,加入足量稀盐酸,仍有沉淀 | 检验溶液中是否含有SO42- |
| D | 常温下测定物质的量浓度相同的盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于CH3COOH |
| A. | A | B. | B | C. | C | D. | D |
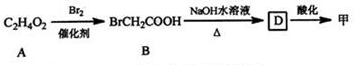
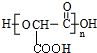 +(n-1)H2O.
+(n-1)H2O.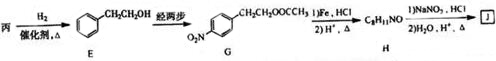
 +(CH3CO)2O→
+(CH3CO)2O→ +CH3COOH.
+CH3COOH. ;D的结构简式为
;D的结构简式为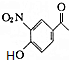 .
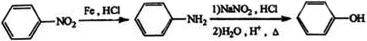
.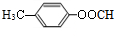 (填结构简式)
(填结构简式)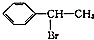 为起始原料制备
为起始原料制备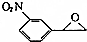 的合成路线:
的合成路线: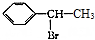 $→_{△}^{NaOH水溶液}$
$→_{△}^{NaOH水溶液}$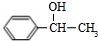 $→_{Cu/△}^{O_{2}}$
$→_{Cu/△}^{O_{2}}$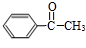 $→_{H_{3}PO_{4}}^{浓HNO_{3}}$
$→_{H_{3}PO_{4}}^{浓HNO_{3}}$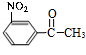 $\stackrel{NaBH_{4}}{→}$
$\stackrel{NaBH_{4}}{→}$