题目内容
5.氮的化合物在日常生活及工、农业生产中涉及广泛,既有其有利的一面,也有其有害的一面.(1)常用作制冷剂的氮的气态氢化物是NH3(填化学式),该气体在空气中与HCl相遇有白烟产生,产生该现象的化学方程式为NH3+HCl=NH4Cl.
(2)铵盐在农业上大多用作化肥.实验室可用NH4Cl和Ca(OH)2固体共热的方法来制备氨气,反应的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
(3)NO是大气污染物之一,用化学方程式表示NO形成酸雨的原因2NO+O2═2NO2、3NO2+H2O═2HNO3+NO.
分析 (1)常用作制冷剂的氮的气态氢化物是氨气,氨气与HCl相遇生成氯化铵;
(2)铵盐可以和强碱反应生成氨气;
(3)NO与空气的主要成份氧气反应生成二氧化氮,二氧化氮与水反应生成硝酸和一氧化氮.
解答 解:(1)常用作制冷剂的氮的气态氢化物是氨气,化学式为:NH3,氨气与HCl相遇生成氯化铵,反应方程式为NH3+HCl=NH4Cl,故答案为:NH3;NH3+HCl=NH4Cl;(2)铵盐可以和强碱反应生成氨气,实验室用氯化铵和氢氧化钙反应来制取氨气,原理方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
(3)NO与空气的主要成份氧气反应生成二氧化氮,反应方程式为:2NO+O2═2NO2,二氧化氮与水反应生成硝酸和一氧化氮,反应方程式为:3NO2+H2O═2HNO3+NO,所以NO对大气的影响之一是导致酸雨,
故答案为:2NO+O2═2NO2、3NO2+H2O═2HNO3+NO.
点评 本题考查学生含氮元素物质的性质以及应用知识,注意知识的归纳和梳理是解题的关键,题目难度不大.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
11.如图是合成一种香料过程的中间产物,下列关于该物质的说法不正确的是( )
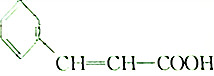
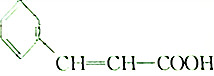
| A. | 该物质能与Na发生反应生成H2 | B. | 该物质能发生加聚反应 | ||
| C. | 该物质在一定件下可发生酯化反应 | D. | 物质的摩尔质量为148 |
13.下列能在无色溶液中大量共存的离子组是( )
| A. | Na+、Ba2+、CO32-、NO3- | B. | Na+、OH-、K+、MnO4- | ||
| C. | K+、HCO3-、SO42-、Na+ | D. | H+、Cl-、Cu2+、SO42- |
10.NA为阿伏伽德罗常数的值.下列说法中不正确的是( )
| A. | 18g冰晶体中含有氢键的数目为2NA | |
| B. | 1molH2O2中含有非极性键的数目为NA | |
| C. | 1molSiO2晶体中含有Si-O键的数目为4NA | |
| D. | 22.4LHF(标准状况)中含有氟原子的数目为NA |
15.在光照条件下,Cl2与CH4反应生成CH3Cl是链式反应,主要反应机理如下:
①Cl2(g)→Cl•(g)+Cl•(g)△H1=+243kJ•mol-1
②Cl•(g)+CH4(g)→CH3•(g)+HCl(g)△H2=+8.4kJ•mol-1
③CH3•(g)+Cl2(g)→CH3Cl(g)+Cl•(g)△H3=-111.8kJ•mol-1
下列有关说法正确的是( )
①Cl2(g)→Cl•(g)+Cl•(g)△H1=+243kJ•mol-1
②Cl•(g)+CH4(g)→CH3•(g)+HCl(g)△H2=+8.4kJ•mol-1
③CH3•(g)+Cl2(g)→CH3Cl(g)+Cl•(g)△H3=-111.8kJ•mol-1
下列有关说法正确的是( )
| A. | Cl•在反应中是催化剂 | |
| B. | Cl•比Cl2更活泼 | |
| C. | ②也可能是Cl•(g)+CH4(g)→CH3Cl(g)+H•(g) | |
| D. | 由③可知C-Cl的键能比Cl-Cl的键能小 |
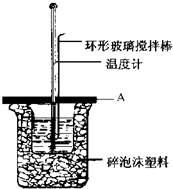 如图所示A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其目的是减少热量损失; 若实验中不加盖泡沫塑料板,则求得的中和热数值(填偏大、偏小、无影响).
如图所示A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其目的是减少热量损失; 若实验中不加盖泡沫塑料板,则求得的中和热数值(填偏大、偏小、无影响).