题目内容
2.将一支试管中盛满甲烷和氯气的混合气体,倒置于盛有饱和食盐水的水槽中,在漫射光的照射下,产生的现象是:①黄绿色气体变浅,②试管内壁附着油状液滴,③水位沿试管上升,④溶液中有沉淀生成.分析 甲烷与氯气在光照条件下发生取代反应生成CH3Cl(气体)、CH2Cl2、CHCl3、CCl4、HCl,氯气逐渐减少甚至消失,氯气的颜色逐渐变浅或消失;反应后有油状液滴(二氯甲烷、三氯甲烷与四氯甲烷)出现;反应过程中气体的体积减小,导致试管内的压强低于外界大气压;氯化氢溶于水后溶液中氯离子浓度增大,导致氯化钠固体析出,溶液的pH变小.
解答 解:甲烷与氯气在光照条件下发生取代反应生成CH3Cl(气体)、CH2Cl2、CHCl3、CCl4、HCl,随着氯气浓度的变小气体颜色变浅,反应生成的氯化氢极易溶于水,水位沿试管上升,反应后有油状液滴(二氯甲烷、三氯甲烷与四氯甲烷)出现;氯化氢溶于水后溶液中氯离子浓度增大,导致氯化钠固体析出,
故答案为:水位沿试管上升;溶液中有沉淀生成.
点评 本题考查了甲烷的取代反应,题目难度不大,解答本题要掌握各种物质的性质和压强等方面的内容,只有这样才能对相关方面的问题做出正确的判断.

练习册系列答案
相关题目
12.下列叙述中能肯定A金属比B金属活泼性强的是( )
| A. | A原子的最外层电子数比B原子的最外层电子数少 | |
| B. | A原子电子层数比B原子电子层数多 | |
| C. | 1mol A从酸中置换 H+生成的H2比 1mol B从酸中置换H+生成的H2多 | |
| D. | A金属可以把B金属从其盐溶液中置换出来 |
13.下列关于SO2的叙述,正确的是( )
| A. | SO2具有漂白性,因而可以使石蕊试液褪色 | |
| B. | 大气中SO2的主要来源是汽车排出的尾气 | |
| C. | SO2是硫酸的酸酐 | |
| D. | SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物 |
10.向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )


| A. | a点对应的溶液中:Na+、OH-、SO42-、NO3- | |
| B. | b点对应的溶液中:H+、Al3+、NO3-、Cl- | |
| C. | c点对应的溶液中:Na+、Ca2+、NO3-、Cl- | |
| D. | d点对应的溶液中:Cl-、NO3-、Fe2+、Na+ |
17.在1.01×105Pa、150℃条件下,某烃完全燃烧反应前后压强不发生变化,该有机物可能是( )
| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C4H10 |
7.实验室用30%左右的硫酸溶液(约3.7mol•L-1)与锌粒反应制取氢气.下列措施中不可能加快反应速率的是( )
| A. | 适当升高温度 | |
| B. | 将锌粒改为锌粉 | |
| C. | 将所用硫酸改为98%左右的硫酸溶液 | |
| D. | 寻找一种合适的催化剂并加入其中 |
14.按碳骨架分类,下列说法正确的是( )
| A. | 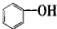 属于醇类化合物 属于醇类化合物 | B. | 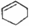 属于芳香族化合物 属于芳香族化合物 | ||
| C. | 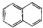 属于脂环化合物 属于脂环化合物 | D. | CH3CH(CH3)2 属于链状化合物 |
11.某同学在实验室进行铁盐与亚铁盐相互转化的实验:
实验Ⅰ:将Fe3+转化为Fe2+(图1)
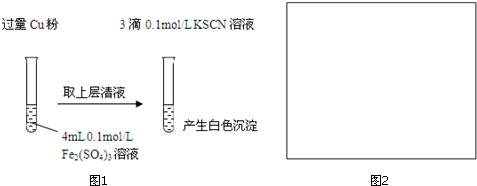
(1)Fe3+与Cu粉发生反应的离子方程式为2Fe3++Cu═2Fe2++Cu2+.
(2)探究白色沉淀产生的原因,请填写实验方案:
查阅资料:
ⅰ.SCN-的化学性质与I-相似,ⅱ.2Cu2++4I-=2CuI↓+I2
Cu2+与SCN-反应的离子方程式为2Cu2++4SCN-=2CuSCN↓+(SCN)2.
实验Ⅱ:将Fe2+转化为Fe3+
探究上述现象出现的原因:
查阅资料:Fe2++NO?Fe(NO)2+(棕色)
(3)用离子方程式解释NO 产生的原因3Fe2++4H++NO3-═3Fe3++NO↑+2H2O.
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应; 反应Ⅱ:Fe2+与NO反应
①依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ慢(填“快”或“慢”).
②乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是取反应后的黄色溶液于试管中,向其中加入几滴K3[Fe(CN)6]溶液,溶液无明显变化,说明反应I是不可逆反应.
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因Fe2+被硝酸氧化为Fe3+,导致溶液中Fe2+浓度降低,导致平衡Fe2++NO?Fe(NO)2+逆向移动,最终Fe(NO)2+完全转化为Fe3+,溶液由棕色变为黄色.
(5)丙认为若生成的NO与Fe2+不接触,溶液就不会出现棕色,请设计实验方案,并画出实验装置图2,实现
Fe2+$\stackrel{稀HNO_{3}}{→}$Fe3+的转化,同时避免出现此异常现象.
实验Ⅰ:将Fe3+转化为Fe2+(图1)

(1)Fe3+与Cu粉发生反应的离子方程式为2Fe3++Cu═2Fe2++Cu2+.
(2)探究白色沉淀产生的原因,请填写实验方案:
查阅资料:
ⅰ.SCN-的化学性质与I-相似,ⅱ.2Cu2++4I-=2CuI↓+I2
| 实验方案 | 现象 | 结论 |
| 步骤1:取4mL0.1mol/L CuSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 产生白色沉淀 | CuSO4与KSCN反应产生了白色沉淀 |
| :步骤2:取取4mL 0.1mol/L FeSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 无明显现象 |
实验Ⅱ:将Fe2+转化为Fe3+
| 实验方案 | 现象 |
| 向3mL 0.1mol/L FeSO4溶液中加入1mL 8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
查阅资料:Fe2++NO?Fe(NO)2+(棕色)
(3)用离子方程式解释NO 产生的原因3Fe2++4H++NO3-═3Fe3++NO↑+2H2O.
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应; 反应Ⅱ:Fe2+与NO反应
①依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ慢(填“快”或“慢”).
②乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是取反应后的黄色溶液于试管中,向其中加入几滴K3[Fe(CN)6]溶液,溶液无明显变化,说明反应I是不可逆反应.
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因Fe2+被硝酸氧化为Fe3+,导致溶液中Fe2+浓度降低,导致平衡Fe2++NO?Fe(NO)2+逆向移动,最终Fe(NO)2+完全转化为Fe3+,溶液由棕色变为黄色.
(5)丙认为若生成的NO与Fe2+不接触,溶液就不会出现棕色,请设计实验方案,并画出实验装置图2,实现
Fe2+$\stackrel{稀HNO_{3}}{→}$Fe3+的转化,同时避免出现此异常现象.
12.下面的叙述正确的是( )
| A. | 使湿润淀粉-KI试纸变蓝色的气体必为氯气 | |
| B. | 氟气与熔融状态下氯化钠反应可产生氯气 | |
| C. | 易见光分解的AgNO3晶体,应存放于棕色细口试剂瓶中 | |
| D. | 溴水应存放在胶头滴瓶(棕色)中 |