题目内容
13.下列关于SO2的叙述,正确的是( )| A. | SO2具有漂白性,因而可以使石蕊试液褪色 | |
| B. | 大气中SO2的主要来源是汽车排出的尾气 | |
| C. | SO2是硫酸的酸酐 | |
| D. | SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物 |
分析 A.二氧化硫不能漂白指示剂;
B.汽车尾气中主要含氮的氧化物;
C.二氧化硫中硫为+4价,与水反应生成亚硫酸;
D.依据二氧化硫中硫为+4价,可以由+6价硫降价得到或者由0或者-2价硫升价得到.
解答 解:A.二氧化硫为酸性氧化性,能够使石蕊变红,虽然具有漂白性,但是二氧化硫不能使石蕊褪色,故A错误;
B.二氧化硫主要来源含硫物质的燃烧,汽车尾气中主要含氮的氧化物,故B错误;
C.SO2与水反应生成亚硫酸,硫酸的酸酐为SO3,故C错误;
D.S、H2S氧化可生成SO2,浓硫酸被还原也可生成SO2,故D正确;
故选:D.
点评 本题考查二氧化硫的性质,熟悉二氧化硫具有氧化性、还原性和漂白性是解题关键,注意二氧化硫不能漂白指示剂,题目难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
3.在核电荷数为1~36的元素中,原子的最外层电子排布满足4S1的元素共有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
8.下列元素中,非金属性最强的是( )
| A. | 硅 | B. | 磷 | C. | 硫 | D. | 氯 |
18.短周期元素X和Y,可组成化合物XY 3,当X的原子序数为m,Y的原子序数可能是( )
①m+4 ②m-4 ③m-8 ④m+2⑤m-6 ⑥m+12.
①m+4 ②m-4 ③m-8 ④m+2⑤m-6 ⑥m+12.
| A. | ①②③ | B. | ①④⑤⑥ | C. | ①②③④⑤ | D. | ①②③④⑤⑥ |
5.某化合物的结构(键线式)及球棍模型如图1:
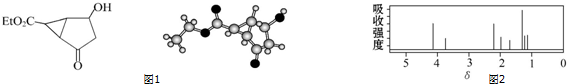
该有机分子的核磁共振氢谱图如图2(单位是ppm):
下列关于该有机物的叙述正确的是( )

该有机分子的核磁共振氢谱图如图2(单位是ppm):
下列关于该有机物的叙述正确的是( )
| A. | 该有机物不同化学环境的氢原子有6种 | |
| B. | 该有机物属于芳香化合物 | |
| C. | 键线式中的Et代表的基团为-CH3 | |
| D. | 该有机物在一定条件下能与金属钠、乙酸发生反应 |
 已知N2和H2在一定条件下发生下列可逆反应:
已知N2和H2在一定条件下发生下列可逆反应: