题目内容
在密闭容器中进行如下反应:X2(g)+Y2(g)  2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
A. Z为0.3mol/L B. Y2为0.4mol/L C. X2为0.2mol/L D. Z为0.4mol/L
练习册系列答案
相关题目
7.设NA为阿伏加德罗常数,下列说法中正确的是( )
| A. | 含1molFeCl3的饱和溶液最多可形成胶体粒子数为NA | |
| B. | 1 ml的水分子与1 mol的氢氧根离子所含电子数均为10NA | |
| C. | 常温、常压下,4.6 g NO2和N2O4混合气体中含有的氧原子数目为0.2NA | |
| D. | 在高温下,有1 mol Fe与足量的水蒸气反应,转移电子的数目为3NA |
7.X、Y、Z、W四种元素,常见化合价均为+2价.己知:X2+与单质W不反应,X2++Z=X+Z2+ Y+Z2+=Y 2++Z.则下列判断正确的是( )
| A. | 氧化性:X 2+>W2+>Y 2+>Z 2+ | |
| B. | 氧化性:W2+>X 2+>Z 2+>Y 2+ | |
| C. | 还原性Y>Z>W>X | |
| D. | 能发生氧化还原反应Z 2++X=X 2++Z |
为了探究原电池的电极名称不仅与电极材料有关还与电解质溶液有关,某学生做了如下的实验
编号 | 电极材料 | 电解质溶液 | 电子流向 |
① | Mg—Al | HNO3(浓) | Mg→Al |
② | Mg—Al | HCl(aq) | Mg→Al |
③ | Mg—Al | NaOH(aq) | Al→Mg |
④ | Al—Cu | HNO3(浓) | Cu→Al |
根据以上表格内容回答:
(1)实验①中Mg作________(填“正极”或“负极”),发生__________(填“氧化反应”或“还原反应”)。
实验③中Mg作________(填“正极”或“负极”),总反应的离子方程式为: ___。
(2)实验②中Al电极上的电极反应式为______________________。
(3)实验④中正极的电极反应式为_________ _____。
15.下列说法中,正确的是( )
| A. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| B. | 需要加热才能发生的化学反应,它可能是吸热反应也可能是放热反应 | |
| C. | 反应产物的总焓大于反应物的总焓时,反应吸热,△H<0 | |
| D. | △H的大小与热化学方程式的计量系数无关 |


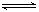 2NH3 △H <0,若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是( )
2NH3 △H <0,若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是( )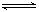 2Z(g)ΔH<0。为了使平衡向生成Z 的方向移动,应选择的条件是( )
2Z(g)ΔH<0。为了使平衡向生成Z 的方向移动,应选择的条件是( )