题目内容
在密闭容器中进行如下反应:N2+3H2 2NH3 △H <0,若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是( )
2NH3 △H <0,若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是( )
(1)平衡不发生移动
(2)平衡沿着正反应方向移动
(3)平衡沿着逆反应方向移动
(4)NH3的质量分数增加
(5)正逆反应速率都增大
A.(1)(5) B.(1)(2)(5) C.(3)(5) D.(2)(4)(5)
练习册系列答案
相关题目
2.氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3=bO2↑+cCl2↑+dHClO4+eH2O.下列有关说法不正确的是( )
| A. | 由电子转移守恒和氯元素守恒可推出2b+a=6c | |
| B. | 若氯酸分解所得混合气体,在相同状态下密度是氢气的25.75信,则反应方程式可表示为:5HClO3=O2↑+Cl2↑+3HClO4+H2O | |
| C. | 由非金属性Cl>S,可推知酸性HClO4>H2SO4 | |
| D. | 若化学计量数a=3,b=2,则该反应转移电子数为10e- |
2.下列关于物质及其用途的关联中不正确的是( )
| A. | 乙醇-燃料 | B. | 蛋白质-生产葡萄糖 | ||
| C. | 淀粉-酿酒 | D. | 油脂-制造肥皂 |
18.以乙醇为基本有机原料自选其他无机试剂,不能合成的物质有( )
| A. | 乙醛 | B. | 乙酸 | C. | 甲烷 | D. | 丙酮 |
10.原子序数依次增大的4种元素a、b、c、d,它们的原子核外L层电子数分别为5、6、8、8.c+的电子层结构与Ne的电子层结构相同,d-比c+多一个电子层.下列叙述正确的是( )
| A. | 元素的非金属性:c>b | |
| B. | a与b只能形成化合物ab和ab2 | |
| C. | c和其他3种元素均能形成离子化合物 | |
| D. | c与d形成的化合物能促进水的电离 |


 4NO(g)+6H2O(g) △H=-1 025kJ/mol,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
4NO(g)+6H2O(g) △H=-1 025kJ/mol,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )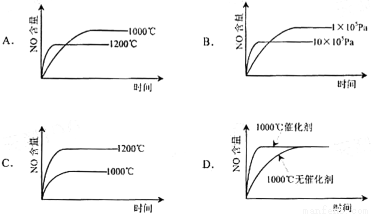
 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( ) 2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol/L,在此时间内,用H2表示的反应速率为0.45mol/(L·s),反应所经过的时间是( )
2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol/L,在此时间内,用H2表示的反应速率为0.45mol/(L·s),反应所经过的时间是( )