题目内容
若NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、1 mol Cl2作为氧化剂得到的电子数为2NA |
| B、14 g氮气中含有7NA个电子 |
| C、在0℃、101 kPa时,22.4 L氢气中含有NA个氢原子 |
| D、NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、Cl2作为氧化剂被还原为Cl-;
B、根据氮气的物质的量并结合氮气中的电子个数来计算;
C、根据n=
计算出氢气的物质的量并结合H2的分子组成来计算;
D、根据m=n?M来计算.
B、根据氮气的物质的量并结合氮气中的电子个数来计算;
C、根据n=
| V |
| Vm |
D、根据m=n?M来计算.
解答:
解:A、Cl2作为氧化剂被还原为Cl-,故1 mol Cl2得2mol电子,即2NA个,故A正确;
B、14 g氮气的物质的量n=
=
=0.5mol,而N2中有14个电子,故0.5molN2中含有的电子数N=0.5×14×NA=7NA,故B正确;
C、在0℃、101 kPa时,气体摩尔体积为22.4L/mol,22.4 L氢气的物质的量n=
=
=1mol,含有的氢原子数为2NA个,故C错误;
D、NA个一氧化碳分子的物质的量n=
=
=1mol,质量m1=n?M=1mol×28g/mol=28g;0.5 mol甲烷的质量m2=n?M=0.5 mol×16g/mol=8g,故质量之比为7:2,故D错误.
故选AB.
B、14 g氮气的物质的量n=
| m |
| M |
| 14g |
| 28g/mol |
C、在0℃、101 kPa时,气体摩尔体积为22.4L/mol,22.4 L氢气的物质的量n=
| V |
| Vm |
| 22.4L |
| 22.4L/mol |
D、NA个一氧化碳分子的物质的量n=
| N |
| NA |
| NA |
| NA |
故选AB.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的运用是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
一位学生在做乙醛的还原性实验时,取1mol?L-1 CuSO4 溶液和0.5mol?L-1 NaOH 溶液各1mL,在一支试管中混合后又加入0.5mL 40%乙醛溶液,结果无红色沉淀产生.实验失败的原因可能是( )
| A、加入的NaOH 不够 |
| B、加入的CuSO4 不够 |
| C、未用水浴加热 |
| D、加入的乙醛太少 |
X、Y、Z、W为四种短周期主族元素,它们在周期表中的位置如图所示.Z元素原子核外K层与M层电子数相等.下列说法中正确的是( )
| X | Y | ||
| Z | W |
| A、原子半径由小到大的顺序为:Y<X<W<Z |
B、X元素最高价氧化物分子的比例模型为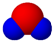 |
| C、Z单质与X元素最高价氧化物、Y单质都能反应,体现氧化性 |
| D、W的单质在地壳含量丰富,是国家经济发展的重要基础原材料.2005年美国科学家发现了W的“超级原子”结构-W13 |
下列有关金属腐蚀与防护的说法正确的是( )
| A、可将地下输油管与外加直流电源的正极相连以保护它不受腐蚀 |
| B、当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C、在海轮外壳连接一锌块保护外壳不受腐蚀是采用了牺牲阴极的阳极保护法 |
| D、纯银器表面在空气中因化学腐蚀渐渐变暗 |
有机物分子 中最多有多少个原子共面( )
中最多有多少个原子共面( )
 中最多有多少个原子共面( )
中最多有多少个原子共面( )| A、12 | B、16 | C、20 | D、24 |
 某研究性学习小组用如图所示装置研究不同能量之间的转化问题.下列说法正确的是( )
某研究性学习小组用如图所示装置研究不同能量之间的转化问题.下列说法正确的是( )| A、断开开关S1,按下开关S2,此时构成的装置属于电解池 |
| B、断开开关S1,按下开关S2,化学能转化为电能,电能转化为光能等 |
| C、断开开关S2,按下开关S1,此时构成的装置属于原电池 |
| D、断开开关S2,按下开关S1,化学能转化为电能 |
下列说法正确的是( )
| A、反应热就是反应中放出的能量 |
| B、在101kPa时,1mol碳燃烧所放出的热量为碳的燃烧热 |
| C、由C(石墨)-→C(金刚石)△H=+1.9kJ/mol可知,金刚石比石墨稳定 |
| D、等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多 |
 如图是一定条件下N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )
如图是一定条件下N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )| A、该反应的热化学方程式为:N2+3H2?2NH3△H=-92kJ?mol-1 |
| B、a曲线是加入催化剂时的能量变化曲线 |
| C、加入催化剂,该化学反应的反应热不变 |
| D、在相同温度的条件下,在体积相同I、II两个容器中分别通入1mol N2和3 mol H2,容器I体积恒定,容器II体积可变保持恒压,则反应过程中两容器内的反应速率v(I)<v(II) |
 铅蓄电池的工作原理为Pb+PbO2+2H2SO4
铅蓄电池的工作原理为Pb+PbO2+2H2SO4| 放电 |
| 充电 |
| A、K 闭合时,d电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42- |
| B、K闭合时,Ⅱ中SO42-向d电极迁移 |
| C、当电路中转移0.2mol电子时,Ⅰ中消耗的H2SO4为0.4 mol |
| D、K闭合一段时间后,Ⅱ可单独作为原电池,d电极为正极 |