题目内容
9.下列有关热化学方程式的叙述正确的是( )| A. | 已知C(石墨,s)=C(金刚石,s)△H>0 则金刚石比石墨稳定 | |
| B. | 已知2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ/mol 则H2的燃烧热为285.8 kJ/mol | |
| C. | 已知2C(s)+O2(g)=2CO(g)△H=-221.0 kJ/mol 则C(碳)的燃烧热为110.5 kJ/mol | |
| D. | 已知2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H=-114.6 kJ/mol 则该反应的中和热为114.6 kJ/mol |
分析 A、物质能量越高越活泼;
B、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量分析;
C、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量分析;
D、中和热是指稀的强酸和强碱反应生成1mol水放出的热量.
解答 解:A、物质能量越高越活泼,C(石墨,s)=C(金刚石,s);△H>0,反应是吸热反应,金刚石能量高,则石墨比金刚石稳定,故A错误;
B、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,已知反应2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ•mol-1,则H2的燃烧热为285.8kJ•mol-1,故B正确;
C、由2C(s)+O2(g)=2CO(g)△H=-221.0 kJ/mol,1mol碳燃烧生成CO放出的热量为110.5 kJ,CO燃烧生成二氧化碳继续放出热量,故1mol碳完全燃烧放出的热量大于110.5 kJ,碳的燃烧热大于110.5 kJ/mol,故C错误;
D、中和热是指稀的强酸和强碱反应生成1mol水放出的热量,2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H=-114.6 kJ/mol 则该反应的中和热为57.3 kJ/mol,故D错误;
故选B.
点评 本题考查了物质能量越高越活泼以及燃烧热、中和热概念分析判断,注意知识的归纳和整理是关键,难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
14.表列出了前20号元素中的某些元素性质的有关数据
下列有关叙述正确的是( )
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | (10) |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | + | =1 | - | + | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |
| A. | 以上10种元素的原子中,失去核外第一个电子所需能量最少的是⑧ | |
| B. | 由⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是PCl5和CCl4 | |
| C. | 某元素R的原子半径为1.02×10-10 m,该元素在周期表中位于第三周期第ⅤA族 | |
| D. | 若物质Na2R3是一种含有非极性共价键的离子化合物,则其化合物的电子式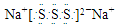 |
15.已知铅蓄电池充放电的总反应为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2H2O+2PbSO4,下列关于铅蓄电池的说法正确的是( )
| A. | 在放电时,两极质量均增加 | |
| B. | 在充电时,电池中硫酸的浓度不断变小 | |
| C. | 在放电时,负极发生的反应是 Pb+2e-+SO42-=PbSO4 | |
| D. | 在放电时,正极发生的反应是 PbSO4+2e-=Pb+SO42- |
12. 短周期元素W、X、Y、Z的原子序数依次增加.甲、乙、丙、丁是由这些元素组成的二元化合物,乙为无色气体,丙为无色液体,丁为淡黄色固体.戊是元素Y的单质,是空气的主要成分,乙遇空气变红棕色,丁与丙反应有戊生成;己是元素Z的单质.上述物质的转化关系如图所示.下列说法错误的是( )
短周期元素W、X、Y、Z的原子序数依次增加.甲、乙、丙、丁是由这些元素组成的二元化合物,乙为无色气体,丙为无色液体,丁为淡黄色固体.戊是元素Y的单质,是空气的主要成分,乙遇空气变红棕色,丁与丙反应有戊生成;己是元素Z的单质.上述物质的转化关系如图所示.下列说法错误的是( )
 短周期元素W、X、Y、Z的原子序数依次增加.甲、乙、丙、丁是由这些元素组成的二元化合物,乙为无色气体,丙为无色液体,丁为淡黄色固体.戊是元素Y的单质,是空气的主要成分,乙遇空气变红棕色,丁与丙反应有戊生成;己是元素Z的单质.上述物质的转化关系如图所示.下列说法错误的是( )
短周期元素W、X、Y、Z的原子序数依次增加.甲、乙、丙、丁是由这些元素组成的二元化合物,乙为无色气体,丙为无色液体,丁为淡黄色固体.戊是元素Y的单质,是空气的主要成分,乙遇空气变红棕色,丁与丙反应有戊生成;己是元素Z的单质.上述物质的转化关系如图所示.下列说法错误的是( )| A. | 原子半径Z>X>Y>W | B. | 丙的热稳定性不如甲 | ||
| C. | X的最高价氧化物的水化物为强酸 | D. | Z的最高价氧化物的水化物为强碱 |
4.一定量的木炭在盛有氮气和氧气混合气体的密闭容器中燃烧后生成CO和CO2,且测得反应后所得CO、CO2、N2的混合气体中碳元素的质量分数为24%,则反应后混合气中氮气的质量分数可能为( )
| A. | 10% | B. | 30% | C. | 50% | D. | 70% |
14.下列依据实验目的所设计的实验操作中正确的是( )
| A. | 检验NaCl中含有Na2CO3,加水溶解 | |
| B. | 鉴别NaCl和Na2CO3溶液,加适量盐酸 | |
| C. | 除去CaO中的CaCO3,加足量稀盐酸 | |
| D. | 除去CO2中少量的CO,通入O2,点燃 |
1.由甲、乙两人组成的实验小组,在同样的实验条件下,用同样的实验仪器和方法进行两组测定中和热的实验,实验试剂及其用量如表所示.
①甲在实验之前预计△H1=△H2.他的根据是A、B中酸与碱的元数、物质的量浓度、溶液体积都相同;乙在实验之前预计△H1≠△H2,他的根据是NaOH是强碱,NH3•H2O是弱碱电离吸热.
②实验测得的温度是:A的起始温度为13.0℃、终了温度为19.8℃;设充分反应后溶液的比热容c=4.184J/(g•℃),忽略实验仪器的比热容及溶液体积的变化,则△H1=-56.9kJ/mol.(已知溶液密度均为1g/cm3)
| 反应物 | 起始温度t1/℃ | 终了温度t2/℃ | 中和热/kJ•mol-1 |
| A.1.0mol/L HCl溶液50mL、1.1mol/L NaOH溶液50mL | 13.0 | △H1 | |
| B.1.0mol/L HCl溶液50mL、1.1mol/L NH3•H2O溶液50mL | 13.0 | △H2 |
②实验测得的温度是:A的起始温度为13.0℃、终了温度为19.8℃;设充分反应后溶液的比热容c=4.184J/(g•℃),忽略实验仪器的比热容及溶液体积的变化,则△H1=-56.9kJ/mol.(已知溶液密度均为1g/cm3)
19.放射性同位素钬${\;}_{67}^{166}$Ho,该同位素原子内的中子数与核外电子数之差为( )
| A. | 38 | B. | 32 | C. | 99 | D. | 166 |