题目内容
16.下列说法不正确的是( )| A. | 食品包装袋中常放入小袋还原铁粉,目的是防止食品氧化变质 | |
| B. | 铝表面有一层致密的氧化膜,故铝制容器可以用来腌制咸菜等 | |
| C. | “埃博拉”病毒在常温下较稳定,对热有中等度抵抗力,56℃不能完全灭活,60℃30min方能破坏其感染性,此过程主要发生了蛋白质的变性 | |
| D. | 为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |
分析 A.防止食品氧化变质,则所加入的物质应该具备吸收氧气的性质;
B.氯离子会破坏铝表面氧化膜;
C.蛋白质在高温时发生变性;
D.废电池中铅、镉、汞等重金属对土壤和水源的污染非常严重.
解答 解:A.铁能与氧气反应,可防止食品氧化变质,故A正确;
B.氯离子会破坏铝表面氧化膜,则不能用铝制容器来腌制咸菜等,故B错误;
C.蛋白质在高温时发生变性,所以60℃30min方能破坏其感染性,此过程主要发生了蛋白质的变性,故C正确;
D.因废电池中铅、镉、汞等重金属对土壤和水源的污染非常严重,所以应积极开发 废电池的综合利用技术,减少土壤和水源的污染,故D正确.
故选B.
点评 本题考查化学与生活,为高频考点,把握物质的性质及化学与生活、环境保护的关系为解答的关键,侧重分析能力及知识应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.向三份0.1mol•L-1 CH3COONa溶液中分别加入少量Na2SO3、NH4NO3、FeCl3固体(忽略溶液体积变化),则CH3COO-的浓度变化依次为( )
| A. | 减小、增大、减小 | B. | 增大、减小、减小 | C. | 减小、增大、增大 | D. | 增大、减小、增大 |
7.有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复).
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象.
(1)A是CH3COONa.
(2)25℃时,0.1mol•L-1 B溶液的pH=a,则B溶液中c(H+)-c(NH3•H2O)=1×10(a-14(用含有a的关系式表示).
(3)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为c(OH-)> c(Ba2+)= c(Cl-)> c(NH4+)> c(H+).
(4)在一定体积的0.005mol•L-1的C溶液中,加入一定体积的0.001 25mol•L-1的盐酸时,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是1:4.
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
(1)A是CH3COONa.
(2)25℃时,0.1mol•L-1 B溶液的pH=a,则B溶液中c(H+)-c(NH3•H2O)=1×10(a-14(用含有a的关系式表示).
(3)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为c(OH-)> c(Ba2+)= c(Cl-)> c(NH4+)> c(H+).
(4)在一定体积的0.005mol•L-1的C溶液中,加入一定体积的0.001 25mol•L-1的盐酸时,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是1:4.
4.将某些化学知识用图象表示,可以收到直观、简明的效果.下列图象所表示的化学知识中,明显不正确的是( )
| A. |  分散系的分类 | |
| B. |  醋酸稀释 | |
| C. | 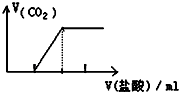 向Na2CO3溶液中逐滴滴入盐酸 | |
| D. | 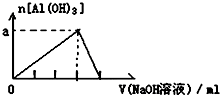 向AlCl3溶液中滴加过量的NaOH溶液 |
11.在0.1mol•L-1的CH3COONa溶液中,下列关系不正确的是( )
| A. | c(Na+)═c(CH3COO-)+c(CH3COOH) | |
| B. | 0.1mol•L-1的CH3COONa溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 将CH3COONa溶解到醋酸中,CH3COONa抑制醋酸的电离 | |
| D. | 等物质的量浓度的CH3COONa、CH3COONH4溶液中c(CH3COO-)不相等 |
1.下列物质①NaHCO3 ②Al ③Al2O3 ④Al(OH)3中,既能与盐酸反应,又能与NaOH溶液反应的是( )
| A. | ③④ | B. | ①③④ | C. | ③ | D. | 全部 |
5.运用化学反应原理研究卤族元素的有关性质具有重要意义.
(1)下列关于氯水的叙述正确的是aef(填写序号).
a.氯水中存在两种电离平衡
b.向氯水中通入SO2,其漂白性增强
c.向氯水中通入氯气,$\frac{c({H}^{+})}{c(ClO-)}$减小
d.加水稀释氯水,溶液中的所有离子浓度均减小
e.加水稀释氯水,水的电离平衡向正反应方向移动
f.向氯水中加少量固体NaOH,可能有c(Na+)=c(Cl-)+c(ClO-)
(2)氯气在工业上有着极其广泛的用途.工业上通过氯碱工业生产氯气,其反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+Cl2↑+H2↑.用惰性电极电解100mL饱和食盐水,当阴极产生标准状况下11.2mL气体,忽略溶液体积的变化时,所得溶液的pH=12.
(3)常温下,已知25℃时有关弱酸的电离平衡常数:
写出84消毒液(主要成分为NaClO)露置在空气中发生反应的有关化学方程式NaClO+CO2+H2O═HClO+NaHCO3.2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑若将84消毒液与洁厕剂(含有浓盐酸)混合使用可能会导致中毒,请用离子方程式解释有关原因ClO-+Cl-+2H+═Cl2↑+H2O.
(1)下列关于氯水的叙述正确的是aef(填写序号).
a.氯水中存在两种电离平衡
b.向氯水中通入SO2,其漂白性增强
c.向氯水中通入氯气,$\frac{c({H}^{+})}{c(ClO-)}$减小
d.加水稀释氯水,溶液中的所有离子浓度均减小
e.加水稀释氯水,水的电离平衡向正反应方向移动
f.向氯水中加少量固体NaOH,可能有c(Na+)=c(Cl-)+c(ClO-)
(2)氯气在工业上有着极其广泛的用途.工业上通过氯碱工业生产氯气,其反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+Cl2↑+H2↑.用惰性电极电解100mL饱和食盐水,当阴极产生标准状况下11.2mL气体,忽略溶液体积的变化时,所得溶液的pH=12.
(3)常温下,已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | HClO | H2CO3 |
| 电离平衡常数 | K=4.7×10-8 | K1=4.3×10-7,K2=5.6×10-11 |
6.短周期元素X、Y、Z、W在周期表中的位置关系如表所示.已知在同周期元素的常见简单离子中,W的离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛.
(1)X元素在元素周期表中的位置是第二周第ⅣA族.
(2)X、Y、Z元素的氢化物均有两种或两种以上.
液态YH3的电离方式与液态H2Z类似,则液态YH3中阴离子的电子式为
(3)以W为材料制成的容器在空气中具有自我保护作用,这种容器不能贮存强碱溶液,用离子方程式表示其原因为Al2O3+2OH-=2AlO2-+H2O、2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)超细WY粉末被应用于大规模集成电路领域.其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:l;其反应的化学方程式为Al2O3+N2+3C $\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.
| X | Y | Z | |
| W |
(2)X、Y、Z元素的氢化物均有两种或两种以上.
液态YH3的电离方式与液态H2Z类似,则液态YH3中阴离子的电子式为

(3)以W为材料制成的容器在空气中具有自我保护作用,这种容器不能贮存强碱溶液,用离子方程式表示其原因为Al2O3+2OH-=2AlO2-+H2O、2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)超细WY粉末被应用于大规模集成电路领域.其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:l;其反应的化学方程式为Al2O3+N2+3C $\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.
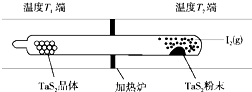 化学反应原理在科研和生产中有广泛应用.
化学反应原理在科研和生产中有广泛应用.