题目内容
5.运用化学反应原理研究卤族元素的有关性质具有重要意义.(1)下列关于氯水的叙述正确的是aef(填写序号).
a.氯水中存在两种电离平衡
b.向氯水中通入SO2,其漂白性增强
c.向氯水中通入氯气,$\frac{c({H}^{+})}{c(ClO-)}$减小
d.加水稀释氯水,溶液中的所有离子浓度均减小
e.加水稀释氯水,水的电离平衡向正反应方向移动
f.向氯水中加少量固体NaOH,可能有c(Na+)=c(Cl-)+c(ClO-)
(2)氯气在工业上有着极其广泛的用途.工业上通过氯碱工业生产氯气,其反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+Cl2↑+H2↑.用惰性电极电解100mL饱和食盐水,当阴极产生标准状况下11.2mL气体,忽略溶液体积的变化时,所得溶液的pH=12.
(3)常温下,已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | HClO | H2CO3 |
| 电离平衡常数 | K=4.7×10-8 | K1=4.3×10-7,K2=5.6×10-11 |
分析 (1)氯水中存在次氯酸的电离和水的电离两种电离平衡;向氯水中通入SO2,二者反应生成硫酸和盐酸,其漂白性减弱;当氯水饱和时再通氯气,c(H+)/c(ClO-)不变,若氯水不饱和再通氯气酸性增强会抑制次氯酸的电离,故比值增大;加水稀释氯水,溶液中的OH-浓度增大;加水稀释氯水,酸性减弱,对水的电离抑制作用减弱,故水的电离平衡向正反应方向移动;向氯水中加入少量固体NaOH,当溶液呈中性时,根据电荷守恒可推导出:c(Na+)=c(Cl-)+c(ClO-).
(2)工业用电解饱和食盐水的方法制备氯气,反应的方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$ 2OH-+Cl2↑+H2↑,当阴极产生标准状况下11.2mL气体,即生成0.0005mol氢气,根据方程式计算生成NaOH的物质的量,进而计算溶液的pH;
(3)由于次氯酸的酸性介于碳酸的两级电离常数之间,因此84消毒液露置在空气中与二氧化碳反应只能生成碳酸氢钠.
解答 解:(1)a.氯水中存在次氯酸的电离和水的电离两种电离平衡,故a正确;
b.向氯水中通入SO2,二者反应生成硫酸和盐酸,其漂白性减弱,故b错误;
c.当氯水饱和时再通氯气,c(H+)/c(ClO-)不变,若氯水不饱和再通氯气酸性增强会抑制次氯酸的电离,故比值增大,故c错误;
d.加水稀释氯水,溶液中的OH-浓度增大,故d错误;
e.加水稀释氯水,酸性减弱,对水的电离抑制作用减弱,故水的电离平衡向正反应方向移动,故e正确;
f.向氯水中加入少量固体NaOH,当溶液呈中性时,根据电荷守恒可推导出:c(Na+)=c(Cl-)+c(ClO-),故f正确;
故答案为:aef;
(2)工业用电解饱和食盐水的方法制备氯气,反应的方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$ 2OH-+Cl2↑+H2↑,当阴极产生标准状况下11.2mL气体,即生成0.0005mol氢气,则生成NaOH0.001mol,c(OH-)=$\frac{0.001mol}{0.1L}$=0.01mol/L,则pH=12,
故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$ 2OH-+Cl2↑+H2↑;12;
(3)由于次氯酸的酸性介于碳酸的两级电离常数之间,因此84消毒液露置在空气中与二氧化碳反应只能生成碳酸氢钠,
方程式为NaClO+CO2+H2O═HClO+NaHCO3,生成的HClO不稳定,见光分解:2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,ClO-与Cl-在酸性条件下发生氧化还原反应生成,离子方程式为ClO-+Cl-+2H+═Cl2↑+H2O,
故答案为:NaClO+CO2+H2O═HClO+NaHCO3;2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑;ClO-+Cl-+2H+═Cl2↑+H2O.
点评 本题综合考查氯气和氯水的性质,题目较为综合,难度较大,注意把握题给信息,根据反应的现象判断生成物进而书写相关反应的方程式.

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案| A. | 不需要通过化学反应就能从海水中获得食盐和淡水 | |
| B. | 推广使用可降解塑料及布质购物袋,无法减少“白色污染” | |
| C. | 严格执行机动车尾气排入标准有利于防止大气污染 | |
| D. | 使用二氧化硫和某些含硫化合物进行增白的食品对人体健康有害 |
| A. | 食品包装袋中常放入小袋还原铁粉,目的是防止食品氧化变质 | |
| B. | 铝表面有一层致密的氧化膜,故铝制容器可以用来腌制咸菜等 | |
| C. | “埃博拉”病毒在常温下较稳定,对热有中等度抵抗力,56℃不能完全灭活,60℃30min方能破坏其感染性,此过程主要发生了蛋白质的变性 | |
| D. | 为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |
| A. | 苯酚钠 | B. | 酯酸钠 | C. | 氢氧化钠 | D. | 石灰水 |
| NaCl | AlCl3 | SiCl4 | 碳化铝 | |
| 熔点 | 810℃ | 190℃ | -68℃ | 2200℃ |
(2)能否用电解熔融AlCl3的方法来制取铝?为什么?不能(填能或否),理由是AlCl3是分子晶体,熔融时不能导电.
| A. |  乙醇 | B. |  金属钠 | C. |  天然气 | D. |  乙酸 |
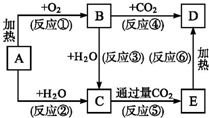 框图中A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色.
框图中A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色.