题目内容
已知用NaAlO2制备α-Al(OH)3及能量转化关系如图:
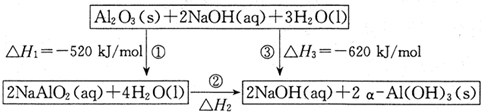
(1)反应②的热化学方程式为 .
(2)根据上述能量转化关系,拜耳公司找到了一种简捷的从铝土矿获取Al2O3的方法,流程如下:
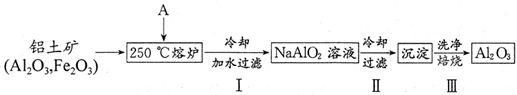
①物质A的化学式为 ;
②步骤Ⅲ的化学反应方程式为 ;检验步骤Ⅲ中沉淀是否洗净的方法是 ;
③步骤Ⅱ采用冷却的方法析出α-Al(OH)3,该措施的依据是 ;
④工业上可电解上述产物Al2O3以获得Al,若获得2.7kg Al,则理论上消耗A的物质的量至少为 mol.有人提出用熔融Na[AlCl4]与NaCl的混合物代替Al2O3进行电解获得Al,则阴极反应为 .

(1)反应②的热化学方程式为
(2)根据上述能量转化关系,拜耳公司找到了一种简捷的从铝土矿获取Al2O3的方法,流程如下:

①物质A的化学式为
②步骤Ⅲ的化学反应方程式为
③步骤Ⅱ采用冷却的方法析出α-Al(OH)3,该措施的依据是
④工业上可电解上述产物Al2O3以获得Al,若获得2.7kg Al,则理论上消耗A的物质的量至少为
考点:用盖斯定律进行有关反应热的计算,物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题,化学反应中的能量变化
分析:(1)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,反应热也处于相应的系数进行相应的加减,构造目标热化学方程式;
(2)①铝土矿的主要成分是Al2O3和SiO2等,加入A需将氧化铝转化为偏氯酸钠,应加碱;
②步骤Ⅲ为氢氧化铝分解生成氧化铝和水的反应;洗涤干净的方法是依据沉淀表面可能附着有的氯化钠,设计实验检验氯离子存在或钠离子的存在;
③根据反应②的热化学方程式分析解答;
④由生成的铝的质量根据化学方程式可以计算出需要的氧化铝的质量,根据Al2O3与NaOH反应的化学方程式,由氧化铝的质量可以计算氢氧化钠的物质的量;阳极发生氧化反应,阴极发生还原反应,
(2)①铝土矿的主要成分是Al2O3和SiO2等,加入A需将氧化铝转化为偏氯酸钠,应加碱;
②步骤Ⅲ为氢氧化铝分解生成氧化铝和水的反应;洗涤干净的方法是依据沉淀表面可能附着有的氯化钠,设计实验检验氯离子存在或钠离子的存在;
③根据反应②的热化学方程式分析解答;
④由生成的铝的质量根据化学方程式可以计算出需要的氧化铝的质量,根据Al2O3与NaOH反应的化学方程式,由氧化铝的质量可以计算氢氧化钠的物质的量;阳极发生氧化反应,阴极发生还原反应,
解答:
解:(1)①Al2O3(s)+2NaOH(aq)=2NaAlO2(aq)+H2O(l),△H=-520KJ/mol,③Al2O3(s)+3H2O(l)=2α-Al(OH)3(s) △H=-620KJmol/mol,
依据盖斯定律
×(③-①)得:NaAlO2(aq)+2H2O(l)=NaOH(aq)+α-Al(OH)3(s) △H=-50kJ/mol,
故答案为:NaAlO2(aq)+2H2O(l)=NaOH(aq)+α-Al(OH)3(s) △H=-50kJ/mol;
(2)铝土矿中加入氢氧化钠溶液,氧化铝和二氧化硅与氢氧化钠反应生成偏铝酸钠和硅酸钠,则滤液Ⅰ为NaAlO2和硅酸钠,加入氢氧化钙,生成硅酸钙沉淀,滤液Ⅱ为偏铝酸钠,可通入二氧化碳气体,生成氢氧化铝,煅烧可生成氧化铝,
①铝土矿的主要成分是Al2O3和SiO2等,加入A需将氧化铝转化为偏氯酸钠,与NaOH反应:Al2O3+2NaOH=2NaAlO2+H2O;SiO2+2NaOH=Na2SiO3+H2O,
故答案为:NaOH;
②步骤Ⅲ为氢氧化铝分解:2Al(OH)3
3H2O↑+Al2O3,洗涤干净的方法是依据沉淀表面可能附着有的氯化钠,设计实验检验氯离子存在或钠离子的存在,钠离子的存在检验比较简便,实验设计为:取最后一次洗涤液做焰色实验,如果火焰没有黄色则已经洗净,反之则未洗净,
故答案为:2Al(OH)3
3H2O↑+Al2O3;取最后一次洗涤液做焰色实验,如果火焰没有黄色则已经洗净,反之则未洗净;
③由反应②的热化学方程式NaAlO2(aq)+2H2O(l)=NaOH(aq)+α-Al(OH)3(s) △H=-50kJ/mol可知:NaAlO2水解生成α-Al(OH)3为放热反应,冷却降温促使NaAlO2水解正向移动或减少α-Al(OH)3在强碱中的溶解,
故答案为:NaAlO2水解生成α-Al(OH)3为放热反应,冷却降温促使NaAlO2水解正向移动或减少α-Al(OH)3在强碱中的溶解;
④设需要电解的氧化铝物质的量为x
2Al2O3
4Al+3O2↑
2mol 4mol
x
x=50mol,根据Al2O3+2NaOH=2NaAlO2+H2O可知:氢氧化钠的物质的量为:100mol,
用熔融Na[AlCl4]与NaCl的混合物代替Al2O3进行电解获得Al,阴极发生还原反应,电极反应式为:AlCl4-+3e-=Al+4Cl-,
故答案为:100;AlCl4-+3e-=Al+4Cl-.
依据盖斯定律
| 1 |
| 2 |
故答案为:NaAlO2(aq)+2H2O(l)=NaOH(aq)+α-Al(OH)3(s) △H=-50kJ/mol;
(2)铝土矿中加入氢氧化钠溶液,氧化铝和二氧化硅与氢氧化钠反应生成偏铝酸钠和硅酸钠,则滤液Ⅰ为NaAlO2和硅酸钠,加入氢氧化钙,生成硅酸钙沉淀,滤液Ⅱ为偏铝酸钠,可通入二氧化碳气体,生成氢氧化铝,煅烧可生成氧化铝,
①铝土矿的主要成分是Al2O3和SiO2等,加入A需将氧化铝转化为偏氯酸钠,与NaOH反应:Al2O3+2NaOH=2NaAlO2+H2O;SiO2+2NaOH=Na2SiO3+H2O,
故答案为:NaOH;
②步骤Ⅲ为氢氧化铝分解:2Al(OH)3
| ||
故答案为:2Al(OH)3
| ||
③由反应②的热化学方程式NaAlO2(aq)+2H2O(l)=NaOH(aq)+α-Al(OH)3(s) △H=-50kJ/mol可知:NaAlO2水解生成α-Al(OH)3为放热反应,冷却降温促使NaAlO2水解正向移动或减少α-Al(OH)3在强碱中的溶解,
故答案为:NaAlO2水解生成α-Al(OH)3为放热反应,冷却降温促使NaAlO2水解正向移动或减少α-Al(OH)3在强碱中的溶解;
④设需要电解的氧化铝物质的量为x
2Al2O3
| ||
2mol 4mol
x
| 2700g |
| 27g/mol |
用熔融Na[AlCl4]与NaCl的混合物代替Al2O3进行电解获得Al,阴极发生还原反应,电极反应式为:AlCl4-+3e-=Al+4Cl-,
故答案为:100;AlCl4-+3e-=Al+4Cl-.
点评:本题考查了热化学方程式的书写方法、二氧化硅和铝及其化合物的性质,为高频考点,侧重与学生的分析能力和实验能力的考查,把握流程中发生的化学反应为解答的关键,题目难度中等.

练习册系列答案
相关题目
化学用语是学习化学的重要工具.下列化学用语正确的是( )
| A、钢铁腐蚀时可能发生的正极反应:4OH--4e-→2H2O+O2↑ |
| B、明矾水解反应的离子方程式:Al3++3H2O→Al(OH)3+3H+ |
C、乙烯的结构式: |
D、苯分子的球棍模型: |
鉴别苯酚溶液,己烷,己烯,乙酸溶液和乙醇5种无色液体,可选用是最佳试剂是( )
| A、酸性KMnO4溶液、新制的Cu(OH)2悬浊液 |
| B、FeCl3溶液、金属钠、溴水、石蕊试液 |
| C、石蕊试液、溴水 |
| D、酸性KMnO4溶液、石蕊试液 |


