题目内容
14.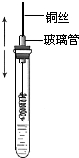 某同学在学习乙醇的知识后,设计了如下的实验. 操作步骤为:
某同学在学习乙醇的知识后,设计了如下的实验. 操作步骤为:①在试管里加入2mL 乙醇;
②把一端弯成螺旋状的铜丝放在酒精灯外焰中加热;
③立即将铜丝插入盛有乙醇的试管里(如图),反复操作几次;
④闻生成物的气味,观察铜丝表面的变化.
试回答下列问题:
(1)该实验的目的是验证乙醇在加热和铜作催化剂条件下,能被空气氧化成乙醛;
(2)第④步操作中,能闻到刺激性 气味;
(3)写出反应的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
分析 (1)由实验②③可知铜首先被氧化生成氧化铜,氧化铜与乙醇反应生成乙醛和铜,可知实验的目的为验证乙醇在加热和铜做催化剂条件下,能被氧气氧化成乙醛;
(2)乙醇能与黑色的氧化铜反应得到乙醛和红色的铜以及水,
(3)根据乙醇能在铜催化下反应得到乙醛和水书写化学方程式.
解答 解:(1)该实验为乙醇的催化氧化反应,铜作催化剂,所以该实验的目的是验证乙醇在加热和铜作催化剂条件下,能被空气氧化成乙醛,
故答案为:验证乙醇在加热和铜作催化剂条件下,能被空气氧化成乙醛;
(2)乙醇能与黑色的氧化铜反应得到乙醛和红色的铜以及水,所以铜丝表面由黑色变成红色,能闻到刺激性的气味,
故答案为:刺激性;
(3)铜丝加热生成氧化铜,方程式:Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;氧化铜与乙醇反应生成铜、乙醛、水,化学方程式:CH3CH2OH+CuO$\stackrel{△}{→}$Cu+CH3CHO+H2O,所以总反应为乙醇能与氧气反应得到乙醛和水:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
点评 本题考查乙醇的性质探究,熟悉乙醇催化氧化的原理是解题关键,侧重考查学生分析、实验能力的考查,题目难度不大.

练习册系列答案
相关题目
5.工业上常利用Na2SO3溶液作为吸收液脱除硫酸工厂烟气中的SO2.下列说法正确的是( )
| A. | NaHSO3溶液中存在:c(Na+)>c(HSO3-)>c(OH-)>c(H+)>c(SO32-) | |
| B. | 当吸收液呈中性时:c(Na+)=2c(SO32-)+c(HSO3-) | |
| C. | 含等物质的量的Na2SO3和NaHSO3的溶液中,阴离子数目相等 | |
| D. | Na2SO3和NaHSO3都能抑制水的电离 |
2.下列属于电解质的是( )
| A. | 蔗糖 | B. | 硫酸铁溶液 | C. | 铜 | D. | 氢氧化钠 |
9.下列物质之间的转化都一步能实现的是( )
| A. | Si→SiO2→H2SiO3→Na2SiO3 | |
| B. | Al→Al2O3→Al(OH)3→NaAlO2 | |
| C. | Na→Na2O→Na2O2→NaOH→Na2CO3→NaHCO3 | |
| D. | S→SO3→H2SO4→SO2→Na2SO3→Na2SO4 |
19.某元素R的核内含有N个中子,R的质量数为A,在其与氢化合时,R呈-n价,则WgR的气态氢化物中所含电子的物质的量为( )
| A. | $\frac{A}{W+n}$(N-m)mol | B. | $\frac{W}{A+n}$(N+n)mol | C. | $\frac{W}{A+n}$(A-N+n)mol | D. | $\frac{W}{A+n}$(N-A-n)mol |
3.设NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 1 mol Cl2溶于水的过程中有1NA个电子转移 | |
| B. | 标准状况下,22.4L NO2气体中含有NA个O2分子 | |
| C. | 常温常压下,15g HCHO含有2NA对共用电子对 | |
| D. | 1L 0.1mol•L-1的醋酸溶液中有NA个CH3COO- |
4.标准状况下,均含有NA个电子的H2O和CH4,具有相同的( )
| A. | 物质的量 | B. | 体积 | C. | 质量 | D. | 氢原子数 |