题目内容
4.亚磷酸(H3PO3)与足量的NaOH溶液反应生成Na2HPO3.(1)亚磷酸是二元酸.
(2)PCl3水解可制取亚磷酸,反应的化学方程式是PCl3+3H2O?H3PO3+3HCl.
(3)在H3PO3溶液中存在电离平衡:H3PO3═H++H2PO3-.
①某温度下0.10mol•L-1H3PO3溶液pH=1.6,即溶液中c(H+)=2.5×10-2 mol•L-1.求该温度下,上述电离平衡的平衡常数K=8.3×10-3mol/L(只考虑H3PO3的第一步电离,结果保留两位有效数字).
②根据H3PO3的性质可推测Na2HPO3稀溶液的pH>7 (填“>”、“=”或“<”).
(4)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:
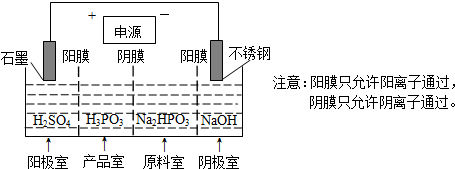
①阴极的电极反应为2H++2e-=H2↑;②产品室中反应的离子方程式为HPO32-+2H+=H3PO3.
(5)亚磷酸具有强还原性,可将Cu2+还原为金属单质,亚磷酸与硫酸铜溶液反应的化学方程式为H3PO3+CuSO4+H2O=Cu+H3PO4+H2SO4.
分析 (1)与足量的NaOH溶液反应生成Na2HPO3,可说明为二元酸;
(2)根据水解反应方程式确定生成物;
(3)①电离平衡常数K=$\frac{C({H}^{+})C({H}_{2}P{{O}_{3}}^{-})}{C({H}_{3}P{O}_{3})}$;
②根据H3PO3的酸性强弱确定Na2HPO3溶液的酸碱性;
(4)①阴极上得电子发生还原反应;
②产品室中HPO32-和氢离子结合 生成亚磷酸;
(5)亚磷酸和Cu2+发生氧化还原反应,亚磷酸作还原剂被氧化生成磷酸,铜离子被还原生成铜,据此写出反应方程式.
解答 解:(1)与足量的NaOH溶液反应生成Na2HPO3,可说明为二元酸,故答案为:二;
(2)PCl3水解可制取亚磷酸和盐酸,水解方程式为:PCl3+3H2O?H3PO3+3HCl,故答案为:PCl3+3H2O?H3PO3+3HCl;
(3)①H3PO3?H++H2PO3-
起始浓度 0.10 0 0
反应浓度 2.5×10-2 2.5×10-2 2.5×10-2
平衡浓度0.10-2.5×10-2 2.5×10-2 2.5×10-2
电离平衡常数K=$\frac{C({H}^{+})C({H}_{2}P{{O}_{3}}^{-})}{C({H}_{3}P{O}_{3})}$=$\frac{2.5×1{0}^{-2}×2.5×1{0}^{-2}}{.10-2.5×1{0}^{-2}}$mol/L=8.3×10-3mol/L,故答案为8.3×10-3mol/L;
②H3PO3是弱酸,Na2HPO3是强碱弱酸盐,所以其水溶液呈碱性,即pH>7,故答案为:>;
(4)①阴极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
②产品室中HPO32-和氢离子结合生成亚磷酸,反应离子方程式为:HPO32-+2H+=H3PO3,故答案为:HPO32-+2H+=H3PO3;
(5)亚磷酸和Cu2+发生氧化还原反应,亚磷酸作还原剂被氧化生成磷酸,铜离子被还原生成铜,据此写出反应方程式为:H3PO3+CuSO4+H2O=Cu+H3PO4+H2SO4;
故答案为:H3PO3+CuSO4+H2O=Cu+H3PO4+H2SO4.
点评 本题考查较为综合,涉及水解反应、氧化还原反应、电极反应式的书写等知识点,电极反应式的书写、有关平衡常数的计算是高考热点,应重点掌握,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 决定化学反应速率的主要因素是参加反应的物质的性质 | |
| B. | 升高温度可使吸热反应的反应速率增大.使放热反应的反应速率减小 | |
| C. | 等量的甲烷在纯氧气中燃烧的火焰的温度比在空气中燃烧时高 | |
| D. | 用物质的量浓度相同的盐酸分别与相同质量的石灰石块和石灰石粉末反应,石灰石快反应速率慢 |
| A. | M(X)>M(Y) | B. | M(X)<M(Y) | C. | M(X)=M(Y) | D. | 无法确定 |
| A. | 立即撤离火灾现场并拨打119报警 | |
| B. | 若逃生通道被堵,应迅速转移到窗口边或阳台上等待救援 | |
| C. | 若被困在室内,应立即封堵火、烟的进口,并站在室内最高处等待救援 | |
| D. | 若被困在火灾现场,应尽可能贴近地面向火势小、烟雾少的方向撤离 |

 ;
; .
. .
.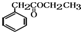 )的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
)的合成路线流程图(无机试剂任选).合成路线流程图示例如下: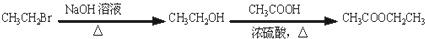
 )是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景.PPG的一种合成路线如下:
)是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景.PPG的一种合成路线如下:


 .
. .
. .
. .
. 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br$→_{加热}^{NaOH/醇}$CH2=CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH.
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br$→_{加热}^{NaOH/醇}$CH2=CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH.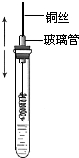 某同学在学习乙醇的知识后,设计了如下的实验. 操作步骤为:
某同学在学习乙醇的知识后,设计了如下的实验. 操作步骤为: