题目内容
9克过氧化钙样品与稀硫酸充分反应产生标准状况下氧气840毫升,则样品中过氧化钙的质量分数为多少?(假定杂质不产生也不消耗氧气)
考点:化学方程式的有关计算
专题:计算题
分析:根据方程式2CaO2+2H2O=2Ca(OH)2+O2↑,列出未量与已知量的关系,求过氧化钙的质量,然后求过氧化钙的质量分数.
解答:
解:设样品中过氧化钙的质量为x,
2CaO2+2H2O=2Ca(OH)2+O2↑
144 22400ml
x 840ml x=5.4 g
过氧化钙的质量分数为:
×100%=60%,
答:样品中过氧化钙的质量分数为60%.
2CaO2+2H2O=2Ca(OH)2+O2↑
144 22400ml
x 840ml x=5.4 g
过氧化钙的质量分数为:
| 5.4g |
| 9g |
答:样品中过氧化钙的质量分数为60%.
点评:本题考查了过氧化钙与水的反应进行计算,中等难度,明确反应原理是解题关键.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
下列各组,前者一定包括后者的是( )
| A、胶体、混合物 |
| B、化合物、纯净物 |
| C、氧化还原反应、置换反应 |
| D、氧化物、碱 |
把足量铝条放入盛有一定体积的稀盐酸的试管中,可使反应速率降低且不影响H2产生量的操作是( )
| A、加入适量CH3COONa溶液 |
| B、加入适量KNO3溶液 |
| C、加入适量的K2CO3溶液 |
| D、加入适量Na2SO4溶液 |
配制500mL 1mol/LHCl溶液时,不需要的仪器是( )
| A、容量瓶(500mL) |
| B、分液漏斗 |
| C、烧杯 |
| D、胶头滴管 |
 将2.7gAl投入50mL CuCl2 和HCl 组成的混合溶液中,充分反应后,产生1.12L(标准状况)气体,过滤出固体残渣后,向滤液中加入5mol?L-1 NaOH溶液,生成的沉淀质量(m)与加入的NaOH溶液的体积(V)关系如图所示,下列说法中正确的是( )
将2.7gAl投入50mL CuCl2 和HCl 组成的混合溶液中,充分反应后,产生1.12L(标准状况)气体,过滤出固体残渣后,向滤液中加入5mol?L-1 NaOH溶液,生成的沉淀质量(m)与加入的NaOH溶液的体积(V)关系如图所示,下列说法中正确的是( )| A、固体残渣的成分为Al、Cu |
| B、滤液中所含的阳离子有H+、Al3+ 和Cu2+ |
| C、关系图中a=20 |
| D、原混合溶液中CuCl2 的物质的量浓度为1mol?L-1 |
按如图所示装置进行下列不同的操作,其中不正确的是( )
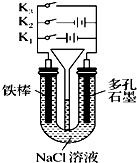

| A、只接通K1,一段时间后,U形管中出现白色沉淀 |
| B、只接通K2,U形管左、右两端液面均下降 |
| C、若U形管左、右两端上方充入一些空气,铁腐蚀的速度由大到小的顺序是:只接通K1>只接通K3>都断开>只接通K2 |
| D、若将氯化钠溶液改为氢氧化钠溶液,铁棒改为多孔石墨,先只接通K2,一段时间后,漏斗内液面上升,然后再只接通K3,则接通K3后装置中无电流通过 |
在常温下Cu(OH)2的Ksp=2×10-20.某CuSO4溶液中c(Cu2+)=0.02mol/L,在常温下如果要生成Cu(OH)2沉淀,需要向CuSO4溶液中加入碱溶液来调整溶液的pH,应该使溶液的pH大于( )
| A、8 | B、9 | C、4 | D、5 |
下列实验装置设计正确,且能达到目的是( )


| A、实验Ⅰ:检查装置的气密性 |
| B、实验Ⅱ:测定未知盐酸的浓度 |
| C、实验Ⅲ:制取并观察Fe(OH)2沉淀 |
| D、实验Ⅳ:吸收HCl气体,并防止倒吸 |