题目内容
10.下列物质属于非电解质的是( )| A. | NH4Cl | B. | Al | C. | AlCl3 | D. | NH3 |
分析 在水溶液或熔融状态下能够导电的化合物为电解质,在水溶液和熔融状态下都不能导电的化合物为非电解质.
解答 解:A.NH4Cl在溶液中能电离出自由移动的离子,溶液能够导电,所以NH4Cl属于电解质,故A不选;
B.Al是单质,既不是电解质也不是非电解质,故B不选;
C.AlCl3是盐在水溶液中电离出自由移动的离子,溶液能够导电,所以AlCl3属于电解质,故C不选;
D.氨气的水溶液能导电,原因是氨气和水反应生成一水合氨,一水合氨能电离出自由移动的阴阳离子而使溶液导电,一水合氨是电解质,但氨气是非电解质,故D选.
故选D.
点评 本题考查了电解质、非电解质概念的理解分析,关键是化合物能否电离出离子,题目较简单.

练习册系列答案
相关题目
1.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列各项的事实不能说明上述观点的是( )
| A. | 乙烯能发生加成反应,而乙烷不能发生加成反应 | |
| B. | 乙基对羟基的影响,使羟基的活性变弱,电离H+的能力不及H2O | |
| C. | 甲苯能使酸性高锰酸钾溶液褪色,而苯不能使酸性高锰酸钾溶液褪色 | |
| D. | 甲苯、苯与硝酸作用得到一硝基取代物的反应条件分别为30℃、50-60℃ |
18.下列实验操作中正确的是( )
| A. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体及上层液体均从下口放出 | |
| D. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
5.明代《天工开物》记载“火法”冶炼锌:“炉甘石十斤,装载入一泥罐内,…然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,…冷淀,毁罐取出,…,即倭铅也”(注:炉甘石的主要成分为碳酸锌,泥罐中掺有煤炭).下列说法不正确的是( )
| A. | 倭铅是指金属锌和铅的混合物 | B. | 煤炭中起作用的主要成分是C | ||
| C. | 我国历史上铅的使用早于锌 | D. | 该冶炼锌的方法属于热还原法 |
15.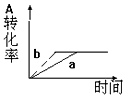 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H<0,图中曲线a 代表一定条件下该反应的过程,若使a曲线变为b曲线,可采用的措施是( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H<0,图中曲线a 代表一定条件下该反应的过程,若使a曲线变为b曲线,可采用的措施是( )
 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H<0,图中曲线a 代表一定条件下该反应的过程,若使a曲线变为b曲线,可采用的措施是( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H<0,图中曲线a 代表一定条件下该反应的过程,若使a曲线变为b曲线,可采用的措施是( )| A. | 增大A的浓度或减少C的浓度 | B. | 缩小容器的容积或加入催化剂 | ||
| C. | 升高温度或增大压强 | D. | 升高温度 |
2.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 室温下,32gO2和O3的混合气体中含有的氧原子数为2NA | |
| B. | 在常温常压下,11.2LN2含有的分子数为0.5NA | |
| C. | 0.5 mol•L-1MgCl2溶液中,含有Cl-个数为NA | |
| D. | 18 g NH4+中所含的电子数为11NA |
13.下列事实中,不能用勒夏特列原理解释的是( )
| A. | 冰镇的啤酒打开后泛起泡沫 | |
| B. | 由H2(g)、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 | |
| C. | 工业制取金属钾Na(l)+KCl(l)?NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来 | |
| D. | 黄绿色的氯水光照后颜色变浅 |