题目内容
12.实验室常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(1)写出该反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)在反应中MnO2是氧化(填“氧化”或“还原”,下同)剂,Cl2是氧化产物.
(3)当0.15mol MnO2参加反应时,被氧化的HCl为0.3 mol,转移电子数为0.3NA.
分析 (1)二氧化锰、氯气、水在离子反应中应保留化学式;
(2)Mn元素的化合价降低,Cl元素的化合价升高;
(3)根据化合价的变化计算转移的电子数,利用MnO2~2HCl计算被氧化的HCl.
解答 解:(1)反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,其离子反应为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)Mn元素的化合价降低,则MnO2为氧化剂,Cl元素的化合价升高,Cl2为氧化产物,
故答案为:氧化;氧化;
(3)当0.15mol MnO2参加反应时,转移电子数为0.15mol×(4-2)×NA=0.3NA,由MnO2~2HCl可知被氧化的HCl为0.15mol×2=0.3mol,
故答案为:0.3;0.3NA.
点评 本题考查氧化还原反应,熟悉氧化还原反应中的基本概念及元素的化合价变化即可解答,注意4molHCl反应时只有2molHCl作还原剂是学生解答的易错点,题目难度不大.

练习册系列答案
相关题目
2.下列说法正确的是( )
| A. | CH3COONa溶液中滴加少量浓盐酸后c(CH3COO-)增大 | |
| B. | 将硫酸铝和氯化铝溶液分别加热蒸干后灼烧,得到的固体都是氧化铝 | |
| C. | 中和体积与物质的量浓度都相同的HCl溶液和CH3COOH溶液消耗NaOH物质的量相同 | |
| D. | 中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗NaOH物质的量相同 |
3. 已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL0.1mol/LCH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( )
已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL0.1mol/LCH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( )
 已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL0.1mol/LCH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( )
已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL0.1mol/LCH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( )| A. | a 点表示的溶液中c(CH3COO-)>10-3mol/L | |
| B. | b 点表示的溶液中c(Na+)>c(CH3COO-) | |
| C. | c 点表示CH3COOH和NaOH恰好反应完全 | |
| D. | b、d 点表示的溶液中$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$均等于K |
20.关于0.1mol/LNa2S水溶液中的下列关系式,正确的是( )
①c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
②c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-)
③c(Na+)=2c(S2-)+2c(H2S)+2c(HS-)
④c(OH-)=c(HS-)+c(H+)+2c(H2S)
①c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
②c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-)
③c(Na+)=2c(S2-)+2c(H2S)+2c(HS-)
④c(OH-)=c(HS-)+c(H+)+2c(H2S)
| A. | 仅① | B. | 仅①② | C. | 仅①②③ | D. | ①②③④ |
4.有Al、CuO、Fe2O3组成的混合物共10.0g,放入500ml某浓度的盐酸溶液中,混合物全部溶解,当再加入250ml 2.00mol/L的NaOH溶液时,得到的沉淀最多.上述盐酸的物质的量浓度是( )
| A. | 0.500mol/L | B. | 1.00mol/L | C. | 2.00mol/L | D. | 3.00mol/L |
2.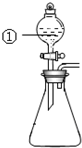 用如图所示装置进行下列实验:将①中溶液滴入锥形瓶中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入锥形瓶中,预测的现象与实际相符的是( )
 用如图所示装置进行下列实验:将①中溶液滴入锥形瓶中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入锥形瓶中,预测的现象与实际相符的是( )| 选项 | ①中物质 | 锥形瓶中物质 | 预测锥形瓶中的现象 |
| A | 浓盐酸 | “84”消毒液 | 有黄绿色气体产生 |
| B | 浓硝酸 | 光洁的铁钉 | 产生红棕色气体 |
| C | 氯化铝溶液 | 浓氢氧化钠溶液 | 先有白色沉淀生成, 后沉淀又溶解 |
| D | 草酸溶液 | 酸性高锰酸钾溶液 | 溶液逐渐褪色, 有黑色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |