题目内容
4.常温下,将铜片投入到下列溶液中,会产生气体的是( )| A. | 稀硫酸 | B. | 浓盐酸 | C. | 稀硝酸 | D. | 浓硫酸 |
分析 Cu的活泼性较弱,与非氧化性酸不反应,与强氧化性酸发生氧化还原反应,据此分析.
解答 解:Cu的活泼性较弱,与非氧化性酸(如稀硫酸、稀盐酸等)不反应,与强氧化性酸反应,如Cu与浓硫酸在加热条件下反应,常温不反应,Cu与浓硝酸在常温下反应生成二氧化氮,Cu与稀硝酸在常温下反应生成一氧化氮,所以常温下,将铜片投入到下列溶液中,会产生气体的是稀硝酸,
故选C.
点评 本题考查了Cu的性质,题目难度不大,注意把握Cu与浓硫酸、硝酸的反应.

练习册系列答案
 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案
相关题目
14.下列各组元素中,按最高正化合价递减的顺序排列的是( )
| A. | C、N、O | B. | S、P、Si | C. | F、O、Br | D. | H、Ca、Al |
12.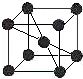 A、B、C、D、E五种元素均位于前四周期,原子序数逐渐增大,只有两种是金属元素.A、B、D三种元素在周期表中相对位置如图,其中A的价层电子排布为ns2np3,C的基态原子的第I电离能远小于第II电离能.E是第四期第IB族元素,回答下列问题:
A、B、C、D、E五种元素均位于前四周期,原子序数逐渐增大,只有两种是金属元素.A、B、D三种元素在周期表中相对位置如图,其中A的价层电子排布为ns2np3,C的基态原子的第I电离能远小于第II电离能.E是第四期第IB族元素,回答下列问题:
(1)E原子的基态电子排布式1s22s22p63s23p63d104s1或[Ar]3d104s1;
(2)A、B、C三种元素的第I电离能由大到小的顺序是N>O>Na,
(3)D能形成多种价态的含氧酸,其酸性由强到弱的顺序为HClO4>HClO3>HClO2>HClO.
(4)已知金属C单质的晶胞为,则C原子的堆积方式为体心立方堆积,C原子的配位数是8,
(5)向E、D形成的稳定化合物溶液中不断加入A的常见氢化物水溶液,最后E的最主要存在形式为(写真实符号)Cu(NH3)42+.
 A、B、C、D、E五种元素均位于前四周期,原子序数逐渐增大,只有两种是金属元素.A、B、D三种元素在周期表中相对位置如图,其中A的价层电子排布为ns2np3,C的基态原子的第I电离能远小于第II电离能.E是第四期第IB族元素,回答下列问题:
A、B、C、D、E五种元素均位于前四周期,原子序数逐渐增大,只有两种是金属元素.A、B、D三种元素在周期表中相对位置如图,其中A的价层电子排布为ns2np3,C的基态原子的第I电离能远小于第II电离能.E是第四期第IB族元素,回答下列问题:| A | B | |
| D |
(2)A、B、C三种元素的第I电离能由大到小的顺序是N>O>Na,
(3)D能形成多种价态的含氧酸,其酸性由强到弱的顺序为HClO4>HClO3>HClO2>HClO.
(4)已知金属C单质的晶胞为,则C原子的堆积方式为体心立方堆积,C原子的配位数是8,
(5)向E、D形成的稳定化合物溶液中不断加入A的常见氢化物水溶液,最后E的最主要存在形式为(写真实符号)Cu(NH3)42+.
9.下列气体①N2 ②O2 ③NO2 ④NO ⑤CO2 ⑥CO中,属于大气污染物的是( )
| A. | ③④⑥ | B. | ①②③④ | C. | ③④⑤⑥ | D. | 全部 |
16.A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:
(1)A元素在周期表中的位置是第二周期第VA族.
(2)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中可能引起的环境问题
有:酸雨(或光化学烟雾)(任写一种).
(3)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是Na3N+4H2O=3NaOH+NH3•H2O.
(4)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若所得溶液的pH=7,则a>b(填“>“或“<”或“=”)
(5)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(6)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol

(7)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极反应式为Fe3++e-=Fe2+.
| … | E | A | B | ||
| C | … | D |
(2)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中可能引起的环境问题
有:酸雨(或光化学烟雾)(任写一种).
(3)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是Na3N+4H2O=3NaOH+NH3•H2O.
(4)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若所得溶液的pH=7,则a>b(填“>“或“<”或“=”)
(5)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(6)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol

(7)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极反应式为Fe3++e-=Fe2+.
13.常温下将一定浓度的一元酸HA和0.1mol•L-1NaOH溶液等体积混合后,下列说法正确的是( )
| A. | 若pH=7,HA的浓度一定为0.1 mol•L-1 | |
| B. | 若pH>7,HA的pH不可能等于1 | |
| C. | 若pH<7,溶液中的微粒浓度关系为:c(Na+)=c(HA)+c(A-) | |
| D. | 若pH=12,且HA为强酸时,HA的浓度应为0.08 mol•L-1 |
14.可以肯定溶液中存在大量SO42-的理由是( )
| A. | 加入AgNO3溶液,有白色沉淀产生 | |
| B. | 加入稀盐酸溶液,无明显现象,再加入BaCl2溶液,产生白色沉淀 | |
| C. | 加入Ba(NO3)2溶液,产生白色沉淀,再加入稀盐酸,沉淀不溶解 | |
| D. | 加入BaCl2溶液,产生白色沉淀,再加入稀盐酸,沉淀不溶解 |
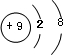 ,该元素与金属性最强的元素形成的化合物的电子式为
,该元素与金属性最强的元素形成的化合物的电子式为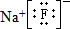 ;该化合物中存在的化学键为离子键 (选填“离子键”或“共价键”).
;该化合物中存在的化学键为离子键 (选填“离子键”或“共价键”).