题目内容
13.常温下将一定浓度的一元酸HA和0.1mol•L-1NaOH溶液等体积混合后,下列说法正确的是( )| A. | 若pH=7,HA的浓度一定为0.1 mol•L-1 | |
| B. | 若pH>7,HA的pH不可能等于1 | |
| C. | 若pH<7,溶液中的微粒浓度关系为:c(Na+)=c(HA)+c(A-) | |
| D. | 若pH=12,且HA为强酸时,HA的浓度应为0.08 mol•L-1 |
分析 A.若pH=7,溶液呈中性,根据酸的强弱判断酸的浓度;
B.根据HA为强酸或弱酸来讨论;
C.根据酸的强弱结合物料守恒判断;
D.根据溶液pH计算HA浓度.
解答 解:A.若pH=7,溶液呈中性,如果酸是一元强酸,酸碱的体积相等,要使溶液呈中性,则酸碱的浓度相等,如果酸是弱酸,要使溶液呈中性,酸越高稍微过量,所以酸浓度大于碱,故A错误;
B.若HA为强酸,当溶液的pH=1时,和0.1mol•L-1NaOH溶液等体积混合后溶液显中性;若HA为弱酸,则和0.1mol•L-1NaOH溶液等体积混合后,HA过量,溶液显酸性,pH<7,故若pH>7时,HA的pH不可能等于1,故B正确;
C.若pH<7,c(H+)>c(OH-),由电荷守恒c(Na+)+c(H+)=c(OH-)+c(A-)可知,c(A-)>c(Na+),c(HA)+c(A-)≠c(Na+),故B错误;
D.若pH=12,且HA为强酸时,设HA的浓度为c,c(OH-)=10-2mol/L=$\frac{0.1mol/L×VL-cmol/L×VL}{2VL}$,c=0.08 mo1.L-1,故D正确;
故选BD.
点评 本题考查了酸碱混合溶液定性判断,根据酸的强弱结合物料守恒、电荷守恒分析解答,很多同学往往只考虑HA为强酸而导致错误,为易错点.

练习册系列答案
相关题目
3.用R元素代表短周期元素,R原子最外层p能级上有2个未成对电子.下列关于R的描述正确的是( )
| A. | R的氧化物都能溶于水 | |
| B. | R的最高价氧化物对应的水化物都是H2RO4 | |
| C. | R一定是非金属元素 | |
| D. | R的最高价氧化物都能与NaOH溶液反应 |
4.常温下,将铜片投入到下列溶液中,会产生气体的是( )
| A. | 稀硫酸 | B. | 浓盐酸 | C. | 稀硝酸 | D. | 浓硫酸 |
1.将铜粉放入稀硫酸中,加热无明显反应,但加入某盐后,发现铜粉质量逐渐减少,该盐是( )
| A. | 硫酸亚铁 | B. | 硫酸锌 | C. | 硝酸钾 | D. | 氯化钠 |
5.近来科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子作溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更加安全.电池总反应式为C2H5OH+3O2═2CO2+3H2O,下列说法不正确的是( )
| A. | C2H5OH在电池的负极上参加反应 | |
| B. | 在外电路中电子由负极沿导线流向正极 | |
| C. | 1 mol乙醇被氧化转移6 mol电子 | |
| D. | 电池正极得电子的物质是O2 |
2.蒿甲醚为我国发现的一种有效的新型抗疟药,该物质为青蒿素的衍生物,青蒿素和蒿甲醚的结构简式如图.下列有关青蒿素和蒿甲醚的说法正确的是( )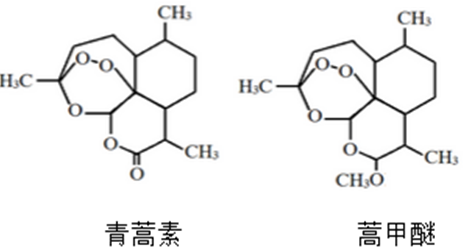

| A. | 蒿甲醚的相对分子质量为295 | |
| B. | 蒿甲醚结构中含有两个酯基 | |
| C. | 二者互为同分异构体 | |
| D. | 二者均既具有氧化性,又具有还原性 |
3.下列有关元素锗及其化合物的叙述中正确的是( )
| A. | 锗的第一电离能高于碳而电负性低于碳 | |
| B. | 四氯化锗与四氯化碳分子都是四面体构型 | |
| C. | 二氧化锗与二氧化碳都是非极性的气体化合物 | |
| D. | 锗和碳都存在具有原子晶体结构的单质 |
