题目内容
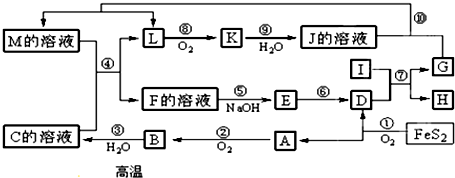
1.对于可逆反应mA(g)+nB(s)?pC(g)+qD(g),根据下列图示回答各小题:
(1)压强,P1比P2小填(大、小).
(2)化学计量数m比p+q小填(大、小).
(3)温度T1℃比T2℃低填(高、低).
(4)正反应放(吸,放)热.
(5)达到平衡后,若增加B的物质的量,则A的转化率将不变(填提高、降低或不变).
分析 由图(1)可知,T2>T1,升高温度,D的体积分数D%减小,说明平衡向逆反应方向移动,则正反应为放热反应;
由图(2)可知,P2>P1,增大压强,D的体积分数D%减小,说明平衡向逆应方向移动,m<p+q,由此分析解答.
解答 解:由图(1)可知,T2>T1,升高温度,D的体积分数D%减小,说明平衡向逆反应方向移动,则正反应为放热反应;
由图(2)可知,P2>P1,增大压强,D的体积分数D%减小,说明平衡向逆应方向移动,m<p+q,
(1)压强,P1比P2 小,故答案为:小;
(2)化学计量数m比p+q小,故答案为:小;
(3)温度T1℃比T2℃低,故答案为:低;
(4)正反应放热反应,故答案为:放;
(5)达到平衡后,B为固体,若增加B的物质的量,平衡不移动,则A的转化率将不变,故答案为:不变.
点评 本题考查化学平衡图象问题,注意把握图象曲线变化,判断外界条件对化学平衡的影响.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
15.在25℃时;用石墨电极电解 CuSO4溶液(假设溶液的体积在电解前后不发生变化).5min后,在一个石墨电极上有6.4g Cu生成.下列说法中正确的是( )
| A. | 有Cu生成的一极是阴极,发生氧化反应 | |
| B. | 反应中转移电子的物质的量为0.4 mol | |
| C. | 在另一极得到O2的体积(标准状况)是1.12 L | |
| D. | 电解一段时间后,溶液的pH不变 |
9.下列离子方程式的书写正确的是( )
| A. | 玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH-═Na2SiO3↓+H2O | |
| B. | 向NaHCO3溶液中加入少量的澄清石灰水,出现白色沉淀:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| C. | 硝酸铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | NaHSO3溶液中投入过氧化钠粉末:4HSO3-+2Na2O2═4SO32-+O2↑+4Na++2H2O |
16.在溶液中能大量共存,加入过量稀盐酸后,溶液中既有沉淀,又有气体产生的离子组是( )
| A. | Cu2+,K+,NO3-,I- | B. | AlO2-,Na+,CO32-,K+ | ||
| C. | Ba2+,Fe3+,Cl-,S2- | D. | K+,SiO32-,S2-,Na+ |
6.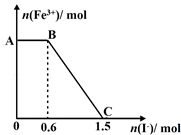 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+,现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+,现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )
 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+,现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+,现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )| A. | 图中AB段的氧化剂为K2Cr2O7 | |
| B. | 图中BC段发生的反应为2Fe3++2I-═2Fe2++I2 | |
| C. | 开始加入的K2Cr2O7为0.25 mol | |
| D. | 共有1molFeSO4被氧化 |
11.硫酸厂有一辆已存放过浓硫酸的铁槽车.某新工人违反规程,边吸烟边用水冲洗,结果发生了爆炸事故.下列引起爆炸的原因中正确的是( )
| A. | 浓硫酸遇明火爆炸 | |
| B. | 浓硫酸遇水发热爆炸 | |
| C. | 铁与水反应产生的氢气接触空气遇明火爆炸 | |
| D. | 稀释后的硫酸与铁反应产生的氢气接触空气遇明火爆炸 |
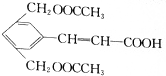 )在氢氧化钠溶液中加热反应后再酸化可得到化合物B和C.回答下列问题:
)在氢氧化钠溶液中加热反应后再酸化可得到化合物B和C.回答下列问题: CH3COOCH2CH3+H2O,该反应的反应类型是酯化(取代)反应
CH3COOCH2CH3+H2O,该反应的反应类型是酯化(取代)反应 (任写一种).
(任写一种).