题目内容
7.含有相同氧原子数的CO和CO2,其质量比为14:11;物质的量比为2:1;碳原子数比为2:1.分析 根据n=$\frac{N}{N{\;}_{A}}$=$\frac{m}{M}$结合物质的构成计算.
解答 解:CO分子含有1个氧原子,CO2分子含有2个氧原子,氧原子数目相同,则n(CO)=2n(CO2),
故n(CO):n(CO2)=2:1,
m(CO):m(CO2)=2×28:1×44=14:11,
二者都含有相同的碳原子数目,故碳原子数之比二者物质的量之比为2:1,
故答案为:14:11; 2:1; 2:1.
点评 本题考查物质的量的有关计算,为高频考点,把握质量、体积、物质的量、微粒数的关系为解答的关键,侧重分析能力及计算能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.设NA表示阿伏加德罗常数,下列说法中不正确的是( )
| A. | 25℃时,纯水中含有的H+数为1×10-7NA | |
| B. | 常温常压下,31g白磷与红磷的混合物中含有磷原子数为NA | |
| C. | 35.5gCl2参加氧化还原反应,转移的电子数可能为NA | |
| D. | 7.8gNa2O2晶体中所含离子的总数为0.3NA |
18.下列反应的离子方程式书写正确的是( )
| A. | 锌溶于醋酸:Zn+2H+=Zn2++H2↑ | |
| B. | 氯气与溴化钠溶液:2Br-+Cl2=Br2+2Cl- | |
| C. | 氯化铝与氨水:Al3++3OH-=Al(OH)3↓ | |
| D. | 氯气溶于水:Cl2+H2O?2H++Cl-+ClO- |
15.有NaCl、MgCl2、AlCl3、FeCl2、FeCl3、CuCl2、NH4Cl七种溶液,只用一种试剂(必要时可加热)就可把它们鉴别开来,这种试剂是( )
| A. | 盐酸 | B. | KSCN溶液 | C. | 氨水 | D. | 烧碱溶液 |
2.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 78g Na2O2与足量水反应中电子转移了2NA | |
| B. | 只有在标准状况下NA个氧气分子的物质的量才是1mol | |
| C. | 16g CH4中含有4 NA个C-H键 | |
| D. | 在铜与硫的反应中(生成硫化亚铜),1 mol铜失去的电子数为2NA |
12.下列混合物能用过滤法分离的是( )
| A. | 酒精和水 | B. | 食盐和蔗糖 | C. | 泥沙和食盐水 | D. | 铜粉和铝粉 |
17.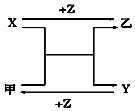 X、Y、Z是三种常见的单质,甲、乙是常见化合物,有如图转化关系(未注明反应条件),下列说法不正确是( )
X、Y、Z是三种常见的单质,甲、乙是常见化合物,有如图转化关系(未注明反应条件),下列说法不正确是( )
 X、Y、Z是三种常见的单质,甲、乙是常见化合物,有如图转化关系(未注明反应条件),下列说法不正确是( )
X、Y、Z是三种常见的单质,甲、乙是常见化合物,有如图转化关系(未注明反应条件),下列说法不正确是( )| A. | 若X、Y均为金属单质,则甲不可能为黑色固体 | |
| B. | 若X为金属单质,Y为非金属固体单质,则Z为O2 | |
| C. | 若X为金属单质,Y为非金属气体单质,则乙可能为黑色固体 | |
| D. | 若X、Y均为非金属固体单质,则Z可能为O2 |